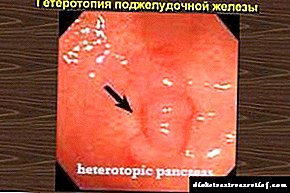
D'Roll vum Protein am mënschleche Kierper

Déi grouss Bedeitung vu Proteine fir de Kierper ass wéinst hire Funktiounen.
Déi präsent Basisfunktioune vu Proteine illustréieren d'Wichtegkeet vun dëser Klass vu Substanzen beim Normal Mënscheliewen.
Am 19. Joerhonnert hunn d'Wëssenschaftler gesot:
- Protein Kierper sinn eenzegaarteg, d'Essenz vum Liewen,
- e konstante Metabolismus tëscht Liewewiesen an der Ëmwelt gebraucht.
Dës Bestëmmunge bleiwen onverännert bis haut.
D'Basis Zesummesetzung vu Proteinen
Déi riesech molekulare Eenheeten vun engem einfachen Protein genannt Protein gi geformt vu chemesch verbonne klengen Block - Aminosaieren mat identesche a verschiddene Fragmenter. Esou strukturell Kompositioune ginn Heteropolymere genannt. Nëmme 20 Vertrieder vun der Klass vun Aminosaieren sinn ëmmer an natierleche Proteine fonnt. D'Basis Zesummesetzung vu Proteine ass geprägt vun der obligatorescher Präsenz vu Kuelestoff - C, Stickstoff - N, Waasserstoff - H, Sauerstoff - O. Schwefel - S gëtt dacks fonnt.An komplexe Proteine genannt Proteiden, ginn aner Substanzen zousätzlech zu Aminosauerreschter enthalen. Deementspriechend Phosphor - P, Kupfer - Cu, Eisen - Fe, Jod - I, Selen - Se kënnen an hirer Zesummesetzung sinn.
Aminocarboxylsäuren aus natierleche Proteine ginn no chemescher Struktur a biologescher Wichtegkeet klasséiert. Chemesch Klassifikatioun ass wichteg fir Chemiker, biologesch - fir jiddereen.
Am mënschleche Kierper sinn et ëmmer zwee Stréimunge vun den Transformatiounen:
- den Decompte, Oxidatioun, Entsuergung vu Liewensmëttelprodukter,
- biologesch Synthese vun neie wesentlechen Substanzen.
12 Aminosaieren aus ëmmer an natierleche Proteine fonnt kënne sech duerch biologesch Synthese vum mënschleche Kierper kreéieren. Si ginn austauschbar genannt.
8 Aminosäuren ginn ni am Mënsch synthetiséiert. Si sinn onverzichtbar, sollte regelméisseg mat Iessen ginn.
Geméiss d'Präsenz vun essentielle Aminokarboxylsäuren, ginn Proteine an zwou Klassen opgedeelt.
- Komplett Proteine hunn all Aminosaier, déi vum mënschleche Kierper gebraucht ginn. Déi erfuerderlech Rei essentielle Aminosaieren enthält Proteine vu Kéisekéis, Mëllechprodukter, Gefligel, Fleesch vu Rind, Mier a Séisswaasserfësch, Eeër.
- Bei defekte Proteine kann eng oder méi wichteg Säuren feelen. Dëst enthält Planzproteine.
Fir d'Qualitéit vu Liewensmëttelproteine ze bewäerten, huet d'medezinesch Weltgemeinschaft se mat engem "idealen" Protein verglach, wat strikt Proportioune vu wesentlechen an essentielle Aminosäuren verifizéiert huet. An der Natur gëtt et keen "Ideal" Protein. Wéi no bei him wéi Déiereproteine. Planzproteine sinn dacks net genuch fir déi normativ Konzentratioun vun enger oder méi Aminosaieren. Wann déi fehlend Substanz derbäi ass, gëtt de Protein komplett.
D'Haaptquelle vu Protein vu Planz an Déier Hierkonft
An der Heemechtswëssenschaftlecher Gemeinschaft déi eng ëmfaassend Studie vun der Liewensmëttelchemie beschäftegt, stellt sech eng Grupp vu Proffen A. P. Nechaev, seng Kollegen a Studenten aus. D'Team huet de Proteingehalt an den Haaptmëttelprodukter, déi um russesche Maart verfügbar sinn, bestëmmt.
- Wichteg! Identifizéiert Figuren informéieren iwwer de Proteingehalt an 100 g vum Produkt, befreit vum inetibelen Deel.
- Déi gréisste Quantitéit un Protein gëtt a Soja, Kürbiskerne, an Erdnüsse fonnt (34,9 - 26,3 g).
- Wäerter vun 20 bis 30 Gramm gi fonnt an Ierzebulli, Bounen, Pistazien a Sonneblummenamen.
- Mandelen, Cashewen, Haselnüsse sinn duerch Zuel vun 15 bis 20 gr charakteriséiert.
- Walnüssen, Nuddelen, déi meescht Getreide (ausser Reis, Mais Gryn) enthalen vun 10 bis 15 Gramm Protein pro 100 Gramm Produkt.
- Reis, Mais Gryn, Brout, Knuewel, gedréchent Aprikosen falen am Beräich vun 5 bis 10 gr.
- An 100 Gramm Kohl, Champignonen, Gromperen, Blummen, e puer Rëndfleeschzorten ass de Proteingehalt vu 2 bis 5 Gramm.
- Rosinen, Rettich, Karotten, séiss Paprika hu wéineg Protein, hir Indikatoren net méi wéi 2 Gramm.
Wann Dir hei net e Planz Objet konnt fannen, da ass d'Protein Konzentratioun an et ze niddreg oder et ass guer net do. Zum Beispill, an Uebstjusen gëtt et ganz wéineg Protein, an natierlechen Geméiswierk - guer net.
- Déi maximal Proteinkonzentratioun gouf a Fëschreese fonnt, haart a verschafft Kéiser, an Huesfleesch (vun 21,1 bis 28,9 g).
- Eng grouss Zuel vu Produkter enthält vu 15 bis 10 Gramm Protein. Dëst ass e Vugel, Mierfësch (ausser fir Kaploun), Rëndfleesch, Garnelen, Quiddelen, Kéis, Feta Kéis, Séisswaasser Fësch.
- Capelin, Poulet Ee, Schweinefleesch enthalen 12,7 bis 15 Gramm Protein pro 100 Gramm Produkt.
- Yoghurt, Curd Kéis zeechent sech duerch d'Zuelen 5 - 7,1 gr.
- Mëllech, Kefir, fermentéiert gebakene Mëllech, sauer Rahm, Creme enthalen vun 2,8 bis 3 Gramm Protein.
Informatioun iwwer d'Haaptquelle vu Proteine vu Planz an Déier Hierkonft a Produkter déi Multi-Stuf technologesch Veraarbechtung gemaach hunn (Stew, Wipp, Ham, Wipp) ass net interessant. Si si net fir regelméisseg gesond Ernärung ze empfeelen. Kuerzfristeg Benotzung vun sou Produkter ass net bedeitend.
D'Roll vum Protein an der Ernärung
Als Resultat vu metabolesche Prozesser am Kierper ginn nei Proteinmoleküle konstant geformt, anstatt déi al. Den Taux vun der Synthese a verschiddene Organer ass net datselwecht. Hormonproteine, zum Beispill Insulin, ginn erëm séier (resynthesiséiert) ganz séier, a Stonnen, Minutten. Proteine vun der Liewer, Darmschleimhaut ginn an 10 Deeg regeneréiert. Proteinmoleküle vum Gehir, Muskelen, Bindegewebe ginn am längsten restauréiert, Restorativ Synthese (Resynthese) ka bis zu sechs Méint daueren.
De Prozess vun der Utilisatioun an der Synthese zeechent sech duerch e Stickstoffbalance.
- An enger geformter Persoun mat voller Gesondheet ass de Stickstoffbalance null. An dësem Fall ass d'Gesamtmass vu Stickstoff mat Proteinen während der Ernährung geliwwert, gläich wéi d'Mass, déi mat Zerfallprodukter ausgeschloss ass.
- Jonk Organismen entwéckele sech séier. De Stickstoffbalance ass positiv. Et gëtt vill Protein, manner gëtt ausgeschloss.
- Bei Alterung, kranke Leit, ass de Stickstoffbalance negativ. D'Mass vu Stéckstoff, déi mat metabolesche Produkter verëffentlecht gëtt, ass méi grouss wéi déi, déi mat der Nahrungsaufnahm kritt.
D'Roll vum Protein an der Ernährung ass eng Persoun mat der erfuerderlecher Quantitéit vun Aminosauerkomponenten ze bidden déi gëeegent sinn fir Participatioun un de biochemesche Prozesser am Kierper.
Fir e normale Metabolismus ze garantéieren, ass et wichteg ze wëssen wéi vill Protein eng Persoun pro Dag brauch ze konsuméieren.
Inlandesch an amerikanesch Physiologen empfeelen iessen 0,8 - 1 g Protein pro 1 kg mënschlecht Gewiicht. D'Zuelen sinn zimmlech averaged. De Betrag hänkt vum Alter, der Natur vun der Aarbecht, der Liewensstil vun enger Persoun of. Am Duerchschnëtt empfeelen se Konsuméiere vu 60 Gramm bis 100 Gramm Protein pro Dag. Fir Männer, déi kierperlech Aarbecht maachen, kann d'Norm op 120 Gramm pro Dag eropgesat ginn. Fir déi, déi Chirurgie ënnerhalen, infektiiv Krankheeten, geet d'Norm och op 140 Gramm pro Dag erop. Diabetiker si recommandéiert Diäten mat engem héijen Inhalt vu Proteinprodukter, déi 140g pro Dag kënne erreechen. Leit mat metabolesche Stéierungen, eng Tendenz zu Gout, solle bedeitend manner Protein konsuméieren. D'Norm fir si ass 20 - 40 Gramm pro Dag.
Fir Leit, déi un aktive Sport involvéiert sinn, déi d'Muskelmasse erhéijen, d'Norm wesentlech eropgeet, kënne 1,6-1,8 Gramm pro 1 kg Sportgewiicht erreechen.
- Wichteg! Et ass ugeroden den Trainer d'Äntwert op d'Fro ze klären - wéivill Proteine solle pro Dag während der Ausübung verbraucht ginn. Professionneller hunn Informatiounen iwwer Energiekäschte fir all Training, Weeër fir den normale Fonctionnement vum Kierper vum Sportler z'erhalen.
Fir d'Ëmsetzung vun alle physiologeschen Funktiounen ass et wichteg net nëmmen d'Präsenz vun essentiellen Aminosaieren am Protein, awer och d'Effizienz vun hirer Assimilatioun. Proteinmolekülen hunn verschidden Niveauen vun der Organisatioun, d'Löslosegkeet, de Grad vun der Accessibilitéit fir Verdauungsenzyme. 96% Mëllechproteine, Eeër gi effektiv opgedeelt. A Fleesch, Fësch, 93-95% Proteine si sécher verdaut. Ausnam sinn d'Proteine vun der Haut an den Hoer. Geméisproteinhalteg Produkter gi vu 60-80% verdaut. A Geméis ginn 80% Proteine absorbéiert, a Gromperen - 70%, a Brout - 62-86%.
De recommandéierten Deel vu Proteinen aus Déierequelle sollt 55% vun der Gesamtbetrag vun der Proteinmass sinn.
- Proteinsmangel am Kierper féiert zu bedeitende metabolesche VerännerungenAn. Esou Pathologien ginn Dystrophie genannt, kwashiorkor. Fir déi éischte Kéier gouf eng Verletzung an den Awunner vun de wilde Stämme vun Afrika opgedeckt, gekennzeechent duerch en negativen Stickstoffbalance, verschlechter Darmfunktioun, Muskelatrophie, a stuntem Wuesstum. Partiell Proteinmangel kann optrieden mat ähnlechen Symptomer, déi fir eng Zäit mëll kënne ginn. Besonnesch geféierlech ass de Mangel u Protein am Kierper vum Kand. Esou Diätstéierunge kënnen d'kierperlech an intellektuell Ënnergeuerdnung vun enger wuessender Persoun provozéieren.
- Exzessiv Protein am Kierper iwwerlaascht den ExkressiounssystemAn. D'Laascht op d'Nieren erop. Mat existent Pathologien am Niergewebe kann de Prozess verschlechtert ginn. Et ass ganz schlecht wann en Iwwerschoss vu Protein am Kierper begleet gëtt vun engem Mangel un aner wäertvolle Liewensmëttelkomponenten. An antiken Zäiten, an de Länner vun Asien gouf et eng Ausféierungsmethod, an där de Veruerteelte nëmme Fleesch gefiddert gouf. Als Resultat ass den Täter gestuerwen aus der Bildung vu verrotten Produkter am Darm, no dëser Vergëftung.
Eng raisonnabel Approche fir dem Kierper Protein ze liwweren garantéiert déi effektiv Operatioun vun alle Liewenssystemer.
Geschicht studéieren

De Protein gouf fir d'éischt (a Form vu Gluten) am Joer 1728 vum Italiener Jacopo Bartolomeo Beccari aus Weessmiel kritt. Proteine goufen an enger separater Klass vu biologesche Molekülle am 18. Joerhonnert isoléiert als Resultat vun der Aarbecht vum franséische Chemiker Antoine de Fourcroix an aner Wëssenschaftler, déi de Besëtz vu Proteine bemierkt hunn fir ze koaguléieren (denaturéieren) ënner dem Afloss vun Hëtzt oder Saieren. Deemools goufe Proteine wéi Albumin ("Ei Wäiss"), Fibrin (Protein aus dem Blutt) a Gluten aus Weesskornen ënnersicht.
Am Ufank vum 19. Joerhonnert gouf e puer Informatiounen iwwer d'Elementskompositioun vu Proteine kritt; et war bekannt datt Aminosaieren während der Hydrolyse vu Proteine geformt ginn. Verschidde vun dësen Aminosaieren (z.B. Glycin an Leucin) goufe scho charakteriséiert. Baséierend op enger Analyse vun der chemescher Zesummesetzung vu Proteinen huet den hollännesche Chemiker Gerrit Mulder hypothese gelooss datt bal all Proteine eng ähnlech empiresch Formel hunn. Am Joer 1836 huet de Mulder den éischte Modell vun der chemescher Struktur vu Proteine proposéiert. Baséierend op der Theorie vun de Radikale koum hien no verschiddene Verfeinerungen zur Konklusioun datt déi minimal strukturell Eenheet vun engem Protein déi folgend Zesummesetzung huet: C40H62N10O12An. Hien huet dës Eenheet "Protein" (Pr) genannt (vum Griichesche. Protos - déi éischt, primär), an d'Theorie - "Proteinetheorie". De Begrëff "Protein" selwer gouf vum schwedesche Chemiker Jacob Berzelius proposéiert. Laut Mulder besteet all Protein aus verschiddene Protein-Eenheeten, Schwefel a Phosphor. Zum Beispill huet hie proposéiert d'Fibrrinformel als 10PrSP ze schreiwen. De Mulder huet och d'Produkter vun der Zerstéierung vu Proteinen - Aminosäuren a fir ee vun hinnen (Leucin) mat enger klenger Fraktiounsfehler studéiert, huet hien d'Molekulargewiicht bestëmmt - 131 Dalton. Mat der Akkumulation vun neien Daten iwwer Proteinen huet d'Theorie vum Protein ugefaang ze kritiséieren, awer trotz dësem, bis de spéiden 1850s gouf et ëmmer nach als universell unerkannt ugesinn.
Um Enn vum 19. Joerhonnert goufen déi meescht vun den Aminosaieren, déi Proteinen ausmachen, ënnersicht. Am spéiden 1880er Joren. De russesche Wëssenschaftler A. Ya.Den Danilevsky huet d'Existenz vu Peptidgruppen (CO - NH) an der Proteinmolekül bemierkt. Am Joer 1894 huet den däitsche Physiolog Albrecht Kossel eng Theorie presentéiert, no där Aminosauren d'Haaptstrukturelementer vu Proteine sinn. Am Ufank vum 20. Joerhonnert huet den däitsche Chemiker Emil Fischer experimentell bewisen datt Proteine aus Aminosaierreschter besteet, verbonne mat Peptidbindungen. Hien huet och déi éischt Analyse vun der Aminosauer Sequenz vum Protein duerchgefouert an d'Erscheinung vun der Proteolyse erkläert.
Déi zentral Roll vu Proteinen an Organismen war awer net bis 1926 unerkannt ginn, wéi den amerikanesche Chemiker James Sumner (spéider e Nobelpräis an der Chemie) gewisen huet datt d'Urease-Enzym e Protein ass.
D'Schwieregkeet fir reng Proteine ze isoléieren huet et schwéier gemaach ze studéieren. Dofir goufen déi éischt Studien duerchgefouert mat Hëllef vu Polypeptiden, déi einfach a grousse Quantitéite gereinegt kënne ginn, dh Bluttproteinen, Pouleteier, verschidde Toxine, souwéi Verdauung / metabolesch Enzyme, déi nom Schluechten vun Véi geheime goufen. Am spéiden 1950er Joren huet d'Firma Rüstung Hot Dog Co. konnt e Kilogramm vu Rëndfleesch ribonuclease A läschen, wat fir vill Studien en experimentellt Zil ass.
D'Iddi datt déi sekundär Struktur vu Proteine d'Resultat vun der Bildung vu Waasserstoffbindungen tëscht Aminosauerreschter ass vum William Astbury am Joer 1933 virgestallt gouf, awer de Linus Pauling gëllt als den éischte Wëssenschaftler deen erfollegräich d'Sekundärstruktur vu Proteine konnt viraussoen. Méi spéit huet de Walter Kauzman, vertrauen op d'Aarbecht vum Kai Linnerstrom-Lang, e bedeitende Bäitrag fir d'Gesetzer vun der Bildung vun der tertiärer Struktur vu Proteinen an der Roll vun hydrophoben Interaktiounen an dësem Prozess ze verstoen. Am spéiden 1940er a fréie 50er Joren huet de Frederick Senger eng Method fir Proteinsekvenséierung entwéckelt, duerch déi hien d'Aminosauer Sequenz vun zwou Insulinketten bis 1955 bestëmmt huet, wat beweist, datt Proteine linear Polymere vun Aminosaieren sinn, an net vertréchent (wéi e puer Zucker) ) Ketten, Kolloiden oder Cyclolen. Den éischte Protein, vun der Aminosaier Sequenz vun där vu sowjetesche / russesche Wëssenschaftler etabléiert gouf, war am Joer 1972 aspartat Aminotransferase.
Déi éischt raimlech Strukturen vu Proteinen, déi duerch Röntgen-Diffraktioun kritt goufen (Röntgen-Diffraktiounsanalyse) goufen an de spéide 1950er a fréie 60er Jore bekannt, a Strukturen entdeckt duerch nuklear magnetesch Resonanz an den 1980er. 2012 huet d'Protein Data Bank ongeféier 87.000 Proteinstrukturen enthalen.
Am 21. Joerhonnert ass Proteinfuerschung op e qualitativen neie Niveau geplënnert, wann net nëmmen individuell geschmollte Proteine studéiert ginn, awer och déi simultan Ännerung vun der Zuel an der post-translationeller Ännerunge vun enger grousser Zuel vu Proteine vun eenzel Zellen, Tissue oder ganz Organismen. Dëse Beräich vun der Biochemie gëtt proteomics genannt. Mat Hëllef vun Bioinformatikmethoden ass et méiglech ginn net nëmmen d'Donnéeën vun der Röntgen-Diffraktiounsanalyse ze veraarbecht, awer och d'Struktur vum Protein op Basis vu senger Aminosauer Sequenz ze virzegoen. De Moment, kryoelektronmikroskopie vu grousse Proteinkomplexe an der Predictioun vun de Raumstrukturen vun Proteindoménë mat Hëllef vu Computerprogrammer sinn op der Atomgenauegkeet ugaang.

Proteingréisst kann a Saache Aminosaierreschter gemooss ginn oder an Dalton (Molekulargewiicht), awer wéinst der relativ grousser Gréisst vun der Molekül gëtt d'Proteinmass an ofgeleet Eenheeten ausgedréckt - Kilodalton (kDa). Hefeproteine besteet am Duerchschnëtt aus 466 Aminosauerreschter an hunn e Molekulargewiicht vun 53 kDa. Dee gréisste Protein deen am Moment bekannt ass - Titin - ass e Bestanddeel vu Muskel-Sarkomeren, dat Molekulargewicht vu senge verschiddenen Varianten (Isoformen) variéiert am Beräich vun 3000 bis 3700 kDa. Titin vum Soleus Muskel (lat. Soleus) vun enger Persoun besteet aus 38.138 Aminosaieren.
Amphoterizitéit
Proteinen hunn den Eegeschafte vun Amphoterizitéit, dat ass, ofhängeg vun de Bedéngungen, se souwuel sauer wéi och Basis Properties. A Proteine ginn et verschidden Aarte vu chemesche Gruppen, déi an ioniséierung an enger wässerlecher Léisung fäeg sinn: Karboxylsäurreschter vun de Säiteketten vun sauere Aminosaieren (Asparagins a Glutaminsäuren) a Stéckstoffhalteg Gruppe vun de Säiteketten vun baseschen Aminosaieren (haaptsächlech déi ε-Aminogrupp vu Lysin an den Amidinreschter CNH (NH2) Arginin, an e bësse manner Ausmooss - d'Imidazolhistidinreschter). All Protein ass geprägt vun engem isoelektresche Punkt (PI) - mëttel Aciditéit (pH), bei där d'total elektresch Ladung vun de Moleküle vun dësem Protein null ass an deementspriechend, si réckelen net am elektresche Feld (zum Beispill, duerch Elektrophorese). Um isoelektresche Punkt ass d'Hydratioun an d'Léisbarkeet vum Protein minimal. De PI-Wäert hänkt vum Verhältnis vu sauer a basesch Aminosaierreschter an engem Protein of: fir Proteinen, déi vill sauer Aminosaierresiduen enthalen, leien isoelektresch Punkte an der saurer Regioun (esou Proteine ginn sauer), a Proteine mat méi Basisreschter, si sinn an der alkalescher Regioun (Basisproteine ) De pI Wäert vun dësem Protein kann och ofhängeg vun der ionescher Stäerkt an der Aart vun der Pufferléisung sinn, an där et steet, well neutral Salzer de Grad vun der Ioniséierung vun de chemesche Gruppe vum Protein beaflossen. De PI vun engem Protein ka bestëmmt ginn, zum Beispill, aus enger Titratiounskurve oder duerch isoelektresch Fokussioun.
Allgemeng hänkt de PI vun engem Protein vun der Funktioun of, déi et mécht: den isoelektresche Punkt vun de meeschte Proteinen a Wirbeldierge Stoffer rangéiert vun 5,5 bis 7,0, awer an e puer Fäll leien d'Wäerter an extremen Gebidder: zum Beispill fir Pepsin, e proteolytescht Enzym vun engem staark sauer Mag Jus pI
1, a fir Salminen - de Protaminprotein vu Lachemëllech, e Feature vun deem en héigen Arginingehalt ass - pI
12. Proteinen, déi un der Nukleinsäure binden wéinst der elektrostatescher Interaktioun mat Phosphatgruppen, sinn dacks d'Haaptproteine. E Beispill vu sou Proteine sinn Histone a Protaminen.
Wat si Proteine?
Proteine sinn héichmolekulär Gewiicht komplex organesch Verbindungen, déi aus Aminosaierreschter bestinn, kombinéiert op eng speziell Manéier. All Protein huet seng eege individuell Aminosaier Sequenz, hir Plaz am Raum. Et ass wichteg ze verstoen datt d'Proteinen, déi an de Kierper kommen, net an eng onverännert Form absorbéiert ginn, si ginn an Aminosaieren ofgebrach a mat hirer Hëllef de Kierper seng Proteine synthetiséiert.
22 Aminosäuren huelen un der Bildung vu Proteine mat, 13 vun hinnen kënnen aneneen ëmgewandelt ginn, 9 - Phenylalanin, Tryptophan, Lysin, Histidin, Threonin, Leucin, Valin, Isoleucin, Methionin - sinn onverversetzbar. De Mangel u irreplacéierbaren Säuren am Kierper ass inakzeptabel, dëst féiert zu Stéierunge vum Kierper.
Et ass wichteg net nëmmen de Fakt datt de Protein am Kierper entgeet, awer och wéi eng Aminosaier et besteet!

Wat ass Protein?
Proteinen (Proteinen / Polypeptiden) - organesch Substanzen, natierlech Polymer mat zwanzeg verbonne Aminosaieren. Kombinatioune bidden vill Aarte. De Kierper këmmert sech mat der Synthese vun zwielef austauschbaren Aminosaieren selwer.
Aacht vun den zwanzeg essentielle Aminosäuren, déi am Protein fonnt ginn, kënnen net eleng vum Kierper synthetiséiert ginn, se gi mat Liewensmëttel kritt. Dëst si Valin, Leucin, Isoleucin, Methionin, Tryptophan, Lysin, Threonin, Phenylalanin, déi wichteg fir d'Liewen sinn.
Wat geschitt Protein
Ënnerscheet tëscht Déier a Geméis (no Hierkonft). Zwou Zorte vu Konsum sinn erfuerderlech.
Déier:
Ee wäiss ass liicht a bal komplett vum Kierper (90-92%) absorbéiert. Proteine vu fermentéierte Mëllechprodukter si liicht verschlechtert (bis zu 90%). Proteine vu frësche ganz Mëllech ginn nach manner absorbéiert (bis zu 80%).
De Wäert vu Rëndfleesch a Fësch an der beschter Kombinatioun vun essentiellen Aminosaieren.
Geméis:
Soja, Canola a Kottessuel hunn e gudden Aminosauer Verhältnis fir de Kierper. Bei Kulturen ass dëse Verhältnis méi schwaach.
Et gëtt kee Produkt mat engem ideale Aminosauer Verhältnis. Richteg Ernährung beinhalt eng Kombinatioun vun Déier- a Geméisproteinen.
D'Basis vun der Ernärung "no de Regelen" ass Déierprotein. Et ass reich an essentielle Aminosaieren, a suergt eng gutt Absorptioun vu Geméisprotein.
Protein Funktiounen am Kierper
Wann et an den Zellen vum Tissu ass, mécht et vill Funktiounen:
- SchutzmoossnamenAn. De Fonctionnement vum Immunsystem ass d'Neutraliséierung vun auslännesche Substanzen. Antikörperproduktioun geschitt.
- TransportAn. D'Versuergung vu verschiddene Substanzen, zum Beispill, Hämoglobin (Sauerstoffversuergung).
- ReguléierungAn. En hormonellen Hannergrond behalen.
- PropulsiounAn. All Typ vu Bewegung suergt Aktin a Myosin.
- PlastikAn. Den Zoustand vum Bindegewebe gëtt kontrolléiert vum Collagen Inhalt.
- KatalyseschAn. Et ass e Katalysator a beschleunegt de Passage vun alle biochemesche Reaktiounen.
- Konservatioun a Iwwerdroung vun der Geninformatioun (DNA a RNA Molekülle).
- EnergieAn. D'Versuergung vum ganze Kierper mat Energie.
Anerer bidden Atmung, si verantwortlech fir d'Verdauung vu Liewensmëttel, reguléieren de Metabolismus. De Fotosensitiv Rhodopsin Protein ass verantwortlech fir d'visuell Funktioun.
Bluttgefässer enthalen elastin, dank si funktionnéieren se voll. De Fibrinogen Protein suergt fir Blutt Koagulatioun.
Symptomer vun engem Mangel u Protein am Kierper
Proteinsmangel ass eng zimlech heefeg Optriede mat Ënnerernährung an engem hyperaktive Liewensstil vun enger moderner Persoun. An enger mëller Form ass et ausgedréckt a reegelméisseger Middegkeet a schlechter Leeschtung. Mat enger Erhéijung vun net genuch Quantitéiten, signaliséiert de Kierper duerch Symptomer:
- Allgemeng Schwächt an Schwindel. Verréngert Stëmmung an Aktivitéit, d'Erscheinung vu Muskelkraut ouni speziell kierperlech Ustrengung, schlechter Koordinatioun vu Bewegungen, Schwächung vun der Opmierksamkeet an Erënnerung.
- Kappwéi a verschlechtert Schlof. Déi resultéierend Insomnia a Besuergnëss bedeit e Manktem u Serotonin.
- Dacks Stëmmungsschwankungen, grunts. Mangel un Enzymen an Hormonen provozéiert Erschöpfung vum Nervensystem: Reizbarkeet aus iergendengem Grond, onverständlech Aggressivitéit, emotional Rehabilitatioun.
- Pale Haut, Hautausschlag. Mat engem Mangel u Eisenhaltende Protein entwéckelt Anämie, d'Symptomer vun deenen sinn Dréchheet a Pallor vun der Haut, Schleimhaut.
- Schwellung vun den Extremitéiten. E niddrege Plasma-Proteingehalt verursaacht d'Waasser-Salzbalance. Subkutan Fett accumuléiert Flëssegkeet an de Knöchel an d'Knöchel.
- Schlecht Heelung vu Wounds an Abrrasiounen. Zellreparatur gëtt hemmt wéinst engem Mank vum "Baustoff".
- Zerbriechlechkeet an Hoerverloscht, Zerbriechlechkeet vun Nägel. D'Erscheinung vu Knascht wéinst dréchen Haut, Peeling a Spléckung vun der Nagelplack ass dat heefegst Signal vum Kierper iwwer e Mangel u Protein. Hoer an Neel wuessen konstant an äntweren direkt op e Mangel u Stoffer, déi de Wuesstum a gudden Zoustand förderen.
- Onredentlech Gewiichtsverloscht. D'Verschwanne vu Kilogramm fir keng offensichtlech Grënn ass wéinst dem Bedierfnes fir de Kierper fir de Mangel u Protein wéinst Muskelmasse ze kompenséieren.
- Ausfall vum Häerz a Bluttgefässer, Erscheinung vu Kürzheet vum Atem. Den Atmungssystem, Verdauungssystemer, an genitourinary Systemer sinn och verschlechtert. Dyspnea erschéngt ouni kierperlech Ustrengung, Houscht ouni Erkältung a Viral Krankheeten.
Mat der Erscheinung vu Symptomer vun dëser Aart, sollt Dir direkt de regime an d'Qualitéit vum Iessen änneren, Äre Lifestyle nei berücksichtegen, a wann et verschlechtert ass, gitt en Dokter.
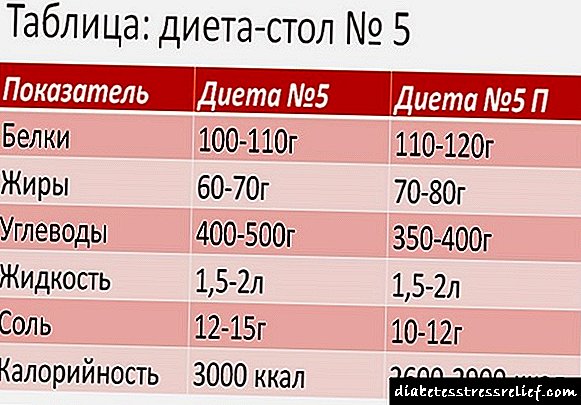
Wéi vill Protein ass fir d'Assimilatioun gebraucht
De Verbrauchstaux pro Dag hänkt vum Alter of, Geschlecht, Aart vun der Aarbecht. D'Daten iwwer d'Standarden ginn an der Tabell (hei ënnendrënner) presentéiert a si fir normal Gewiicht entworf.
Kréien Protein ofgeroden e puer Mol ass fakultativ. Jidderee bestëmmt eng bequem Form fir sech selwer, d 'Haaptsach ass den deeglechen Opnamequote.
| Aarbecht Aktivitéit + |
kierperlech Aktivitéit
Héich Protein Inhalt a Liewensmëttel
Erkannt Protein-enthaltend Liewensmëttel:
Vun all de Varietéiten vu Fleesch ass déi éischt Plaz nom Gefligelgehalt Rëndfleesch: 18,9 g. Duerno, Schwäin: 16,4 g, Lämmchen: 16,2 g.
D'Mais an d'Kaweechele sinn d'Cheffen: 18,0 g.
De räichste Fësch fir Protein ass Lachs: 21,8 g, duerno rosa Lachs: 21 g, Hiecht-Staang: 19 g, Makrell: 18 g, Herring: 17,6 g a Kabel: 17,5 g.
Ënner Mëllechprodukter, Kefir a Sauer Creme halen d'Positioun fest: 3,0 g, dann Mëllech: 2,8 g.
Héichkorn - Hercules: 13,1 g, Hirse: 11,5 g, Semulina: 11,3 g
Wësst d'Norm a berücksichtegt finanziell Méiglechkeeten, kënnt Dir e Menü korrekt komponéieren a gitt sécher datt et mat Fetter a Kuelenhydrater ergänzt.
De Verhältnis vu Protein an der Ernährung
Den Undeel vu Proteinen, Fette, Kuelenhydrater an enger gesonder Ernärung sollt (a Gramm) 1: 1: 4 sinn. De Schlëssel fir d'Gläichgewiicht vun engem gesonde Plat kann op eng aner Manéier representéiert ginn: Proteine 25-35%, Fetter 25-35%, Kuelenhydrater 30-50%.
Zur selwechter Zäit solle Fette nëtzlech sinn: Olivenueleg oder Leinsamenuelech, Nëss, Fësch, Kéis.
Kohlenhydrater an enger Platte sinn haart Nuddelen, all frësch Geméis, souwéi Uebst / gedréchent Friichten, Sauermëllech Produkter.
Proteinen an Portiounen kënnen optional kombinéiert ginn: Geméis + Déieren.
Aminosaier Saieren enthalen an Protein
Déi interchangeable ka vum Kierper selwer synthetiséiert ginn, awer hir Versuergung vu baussen ass ni iwwerflësseg. Besonnesch mat engem aktive Liewensstil a grousser kierperlecher Ustrengung.
All ouni Ausnahm si wichteg, déi populär vun hinnen:
Alanine.
Et stimuléiert de Metabolismus vu Kuelenhydrater, hëlleft Toxine ze eliminéieren. Verantwortlech fir "Propretéit". Héich Inhalt a Fleesch, Fësch, Mëllechprodukter.
Arginine.
Et ass noutwendeg fir Muskelen, eng gesonde Haut, Knorpel a Gelenker ze contractéieren. Bitt Fettverbrennung an Immunsystem Funktioun. Et ass an all Fleesch, Mëllech, an Nëss, Gelatin.
Asparaginsäure.
Bitt Energiebalance. Verbessert d'Funktionalitéit vum Zentralnervensystem. Gutt d'Energieressource vun Rëndfleesch a Poulet Platen, Mëllech, Réi Zocker ersat. Befaasst a Gromperen, Nëss, Getreide.
Histidine.
Den Haapt "Builder" vum Kierper gëtt an Histamin a Hämoglobin transforméiert. Schnell heelen Wounds, ass verantwortlech fir Wuesstemechanismen. Relativ vill a Mëllech, Getreide an all Fleesch.
Roueg.
Neurotransmitter, onverzichtbar fir de kloere Fonctionnement vum Gehir an Zentralnervensystem. Et gi Peanuts, Fleesch, Getreide, Soja.
Mat der richteger Ernährung an dem richtege Liewensstil erschéngen all Aminosaieren am Kierper fir d'Synthese vun "Kubel" a Modellerung vun der Gesondheet, Schéinheet a Liewensdauer.
Wat bewierkt e Mangel u Protein am Kierper
- Heefeg infektiiv Krankheeten, Schwächung vum Immunsystem.
- Stress an Besuergnëss.
- Aging a verlangsamt vun alle metabolesche Prozesser.
- Eng Nebenwirkung vun der Verwäertung vun eenzelne Medikamenter.
- Feeler am Verdauungstrakt.
- Verletzungen.
- Liewensmëttel baséiert op Fastfood, Direktprodukter, hallefaarf Produkter vun der gerénger Qualitéit.
Mangel vun enger eenzeger Aminosaier wäert d'Produktioun vun engem spezifesche Protein stoppen. De Kierper ass organiséiert nom Prinzip vun "Füllen vun de Vullen", sou datt déi fehlend Aminosäuren aus anere Proteine ginn. Dëse "Neesopbau" stéiert d'Fonktionnéiere vun Organer, Muskelen, Häerz, Gehir a provozéiert duerno d'Krankheet.
Proteinsmangel bei Kanner hemmt de Wuesstem, verursaacht kierperlech a geeschteg Behënnerungen.
D'Entwécklung vun Anämie, d'Erscheinung vu Hautkrankheeten, Pathologie vu Schanken an Muskelgewebe ass net eng komplett Lëscht vu Krankheeten. Schwer Proteindystrophie kann zu Wahnsinn an der kwashiorkor féieren (Aart vu schwéiere Dystrophie wéinst Mangel u Proteinen).
Wann Protein de Kierper schueden
- iwwerschësseg Empfang
- chronesch Krankheeten vun der Liewer, Nieren, Häerz a Bluttgefässer.
Iwwerschoss geschitt net dacks wéinst onkomplett Absorptioun vun enger Substanz duerch de Kierper.Et geschitt an déi, déi Muskeln esou séier wéi méiglech wëllen erhéijen ouni d'Recommandatioune vun Traineren an Ernärter ze folgen.
D'Problemer vum "Iwwerschoss" Empfang enthalen:
Nierenversoen. Exzessive Quantitéiten u Protein Iwwerlaascht Organer, déi hir natierlech Funktioun gestéiert. "Filter" kann net mat der Belaaschtung këmmeren, Nierkrankheet erschéngt.
Liewer Krankheet. Excess Protein accumuléiert Ammoniak am Blutt, wat de Konditioun vun der Liewer verschlechtert.
D'Entwécklung vun Atherosklerosis. Déi meescht Déiereprodukter enthalen nieft nëtzlechen Substanzen schiedlech Fett a Cholesterol.
Leit, déi un der Pathologie vun der Liewer, Nieren, Kardiovaskulär a Verdauungssystemer leiden, sollen d'Intake vu Protein limitéieren.
Pfleeg fir hir eege Gesondheet gëtt praktesch belount fir déi, déi sech Suergen maachen. Fir schwéier Konsequenzen ze vermeiden, musst Dir de Kierper säin Erhuelungsbedarf erënneren. E komplette Rescht, Ernärung, Besuchspezialisten verlängeren d'Jugend, d'Gesondheet an d'Liewen.
Solubilitéit
Proteine variéieren d'Léisbarkeet am Waasser. Waasserlöslech Proteine ginn Albumin genannt, dës enthalen Blutt a Mëllechproteine. Zu Onoplosbar, oder Skleroproteine, enthalen zum Beispill Keratin (de Protein dat d'Hoer ausmécht, d'Hoer vu Mamendéieren, Fieder vun de Vullen, asw.) A Fibrin, deen Deel vu Seid a Spawebs ass. D'Léisbarkeet vun engem Protein gëtt bestëmmt net nëmmen duerch seng Struktur, awer duerch extern Faktoren, wéi d'Natur vum Léisungsmëttel, d'ionesch Stäerkt an de pH vun der Léisung.
Proteine ginn och a hydrophil (waassléislech) an hydrophob (waasserdichtend) opgedeelt. Déi meescht Proteine vum Zytoplasma, Käre, an interzellular Substanz, och onoplosbar Keratin a Fibroin, sinn hydrofil. Déi meescht vun de Proteinen, déi biologesch Membranen ausmaachen, sinn hydrophobesch - integral Membranproteine, déi interagéieren mat hydrophobe Lipiden vun der Membran (dës Proteine hunn, an der Regel, och hydrophilesch Site).
Protein Biosynthese am Kierper
Proteinbiosynthese - d'Bildung am Kierper vun de gewënschte Proteinen aus Aminosaieren andeems se mat enger spezieller Aarte vu chemescher Verbindung kombinéiert ginn - d'Polypeptid Kette. DNA späichert Proteinstruktur Informatioun. D'Synthese selwer fënnt an engem speziellen Deel vun der Zell statt genannt Ribosome statt. RNA iwwerdréit Informatioun vum gewënschten Gen (DNA Site) an de Ribosome.
Zënter Proteinbiosynthese ass multistage, komplex, benotzt d'Informatioun festgeluecht an der Basis vun der mënschlecher Existenz - DNA, seng chemesch Synthese ass eng schwiereg Aufgab. Wëssenschaftler hunn geléiert wéi Inhibitoren vu gewëssen Enzymen an Hormonen kréien, awer déi wichtegst wëssenschaftlech Aufgab ass Proteine mat genetescher Ingenieursaarbecht ze kréien.

Transport
D'Transportfunktioun vun engem speziellen Bluttprotein - Hämoglobin. Dank dësem Protein gëtt Sauerstoff aus de Longen an d'Uergelen an Tissuë vum Kierper geliwwert.
Et besteet an der Aktivitéit vu Proteine vum Immunsystem, genannt Antikörper. Et ass Antikörper, déi d'Gesondheet vum Kierper bewaache, schützen et vu Bakterien, Virussen, Gëft, an et erlaabt Blutt e Stiefsel am Plaz vun enger oppener Wonn ze bilden.
D'Signalfunktioun vu Proteinen ass d'Signaler (Informatioun) tëscht Zellen ze vermëttelen.
Protein Normen fir en Erwuessene
De Bedierfnes vum mënschleche Kierper fir Protein hänkt direkt vu senger kierperlecher Aktivitéit of. Wat méi mir plënneren, dest méi séier all biochemesch Reaktiounen ginn an eisem Kierper vir. Leit, déi regelméisseg üben, brauche bal duebel sou vill Protein wéi d'Moyenne Persoun. Mangel u Protein fir Leit, déi un Sport involvéiert sinn, ass geféierlech "ausdrocken" vun de Muskelen an der Erschöpfung vum ganze Kierper!
Am Duerchschnëtt gëtt d'Proteinnorm fir en Erwuessene berechent op Basis vun engem Koeffizient vun 1 g Protein pro 1 kg Gewiicht, also ongeféier 80-100 g fir Männer, 55-60 g fir Fraen. Männlech Sportler ginn berode fir d'Quantitéit vum Protein ze konsuméieren, deen op 170-200 g pro Dag verbraucht gëtt.

Proper Protein Ernährung fir de Kierper
Richteg Ernärung fir de Kierper mat Protein ze sättelen ass eng Kombinatioun vun Déieren- a Planzproteinen. De Grad vun Assimilatioun vu Protein aus Iessen hänkt vu senger Hierkonft an der Method vun der Wärmebehandlung of.
Also, ongeféier 80% vun der Gesamtopnahm vum Déierprotein a 60% vum Geméisprotein ginn duerch de Kierper absorbéiert. Produkter vun Déiere Hierkonft enthalen e gréissere Betrag u Protein pro Masseenheet vum Produkt wéi a Geméis. Zousätzlech enthält d'Zesummesetzung vun "Déiereprodukter" all Aminosaieren, a Planzeprodukter an dësem Beräich gi manner schlëmm.
Basis Ernärungsregele fir besser Proteinabsorptioun:
- Eng sanft Manéier fir ze kachen - Kachen, Dampen, Stehen. Frittéiere sollt ausgeschloss ginn.
- Et ass recommandéiert méi Fësch a Gefligel ze iessen. Wann Dir wierklech Fleesch wëllt, wielt Rëndfleesch.
- Brühe soll aus der Diät ausgeschloss ginn, si si fetteg a schiedlech. An extremen Fäll kënnt Dir den éischte Plat mat der "sekundärer Bouillon" kachen.
Features vun der Protein Ernärung fir Muskelwachstum
Sportler déi aktiv Muskelmasse gewannen, solle sech un all déi uewe genannte Empfehlungen halen. Déi meescht vun hirer Ernärung solle Proteine vun Déieren ofstamen. Si sollten a Verbindung mat Geméisproteinprodukter giess ginn, vun deenen d'Soy eng besonnesch Präferenz ass.
Et ass och noutwendeg en Dokter ze konsultéieren an d'Benotzung vu speziellen Protein Drénken ze berücksichtegen, de Prozentsaz vun der Proteinabsorptioun vun deenen 97-98% ass. De Spezialist wäert individuell e Patt auswielen, berechnen déi richteg Doséierung. Dëst wäert eng agreabel an nëtzlech Protein Zousaz fir Stäerktraining sinn.
Denaturéierung
Protein-Denaturatioun bezitt sech op all Ännerungen a senger biologescher Aktivitéit an / oder physikalesch chemesch Eegeschafte verbonne mam Verloscht vun enger quaterernärer, tertiärer oder sekundärer Struktur (kuckt d'Rubrik "Proteinstruktur"). In der Regel, Proteine si ganz stabil ënner dëse Bedéngungen (Temperatur, pH, asw.) An deem se normalerweis am Kierper funktionnéieren. Eng schaarf Ännerung an dëse Bedéngungen féiert zu Protein-Nämung. Ofhängeg vun der Natur vum Denaturéierungsmëttel, mechanesch (staark Rüren oder Schücken), kierperlech (Heizung, Ofkillung, Bestrahlung, Sonikatioun) a chemesch (Säuren an Alkalien, Surfaktanten, Harnstoff) Denaturatioun.
Protein-Denaturatioun kann komplett oder deelweis, reversibel oder irreversibel sinn. Dee bekanntste Fall vun irreversiblen Proteindenaturatioun am Alldag ass d'Virbereedung vun engem Poulet Ee, wann, ënner Afloss vun héijer Temperatur, de waasslösleche transparenten Protein Ovalbumin dicht, onoplosbar an opak gëtt. Denaturéierung an e puer Fäll ass reversibel, sou wéi am Fall vun Nidderschlag vu Waasserléisleche Proteine mat Ammoniumsalz (Salzoutmethod), an dës Method gëtt als Wee benotzt fir se ze botzen.
Proteinmoleküle si linear Polymerer, déi aus Iwwerreschter vun α-L-Aminosäuren bestinn (déi Monomer sinn), an och modifizéiert Aminosauerreschter a Komponente vun net-Aminosaier Natur kënnen an der Zesummesetzung vu Proteinen abegraff ginn. An der wëssenschaftlecher Literatur gi Een- oder dräi-Bréif Ofkierzungen benotzt fir op Aminosaieren ze bezéien. Obschonn et op den éischte Bléck schéngt wéi wann d'Benotzung vun "nëmmen" 20 Aarte vun Aminosaieren an de meeschte Proteinen d'Diversitéit vun de Proteinstrukturen limitéiert, ass d'Unzuel vun den Optiounen kaum ze iwwerschätzen: fir eng Kette vu 5 Aminosaierreschter ass et scho méi wéi 3 Milliounen, an eng Kette vun 100 Aminosaierreschter. (klengt Protein) ka a méi wéi 10.130 Varianten vertruede sinn. Proteine vun 2 bis e puer Zénger vun Aminosauerreschter an der Längt ginn dacks genannt peptides, mat engem gréissere Grad vun der Polymeriséierung - Kaweechelcher, obwuel dës Divisioun ganz arbiträr ass.
Wann e Protein entsteet als Resultat vun der Interaktioun vun enger α-Carboxyl Grupp (-COOH) vun enger Aminosaier mat enger α-Aminogrupp (-NH2) vun enger anerer Aminosaier, Peptidbindunge geformt. D'Ennen vum Protein ginn den N- an C-Uschloss genannt, ofhängeg vun wéi enger vun de Gruppen vum uerdentlechen Aminosauerreschter fräi: -NH2 oder -COOH, respektiv. An der Proteinsynthese um Ribosom ass den éischten (N-terminalen) Aminosauerreste meeschtens de Methioninreschter, a spéider Reschter sinn op den C-Uschloss vum virdru verbonnen.
Feature vun Protein Ernärung, Diäter
Déi, déi Gewiicht verléiere wëllen, solle Déiere- a Geméisproteinprodukter iessen. Et ass wichteg hir Intake ze trennen, well d'Zäit fir hir Assimilatioun anescht ass. Fatty Fleeschprodukter sollen entzunn ginn, Kartoffel däerfen net mëssbraucht ginn, Getreide mat engem duerchschnëttleche Proteingehalt solle léiwer ginn.
Gitt net op Extremen an "sëtzt" op enger Protein Diät. Et passt net fir jiddereen, well d'komplett Ausgrenzung vu Kuelenhydrater féiert zu enger Ofsenkung vun der Aarbechtskapazitéit an der Energie. Et ass genuch fir moies Liewensmëttel ze iessen déi Kuelenhydrater enthalen - dat gëtt Energie am Dag, am Nomëtteg Protein mat fettarme Liewensmëttel. Fir de Mangel un Energie am Owend ze kompenséieren, fänkt de Kierper Kierperfett ze verbrennen, awer dëse Prozess ass sécher fir d'Gesondheet vum Kierper.
Gitt sécher déi richteg a richteg preparéiert Protein Liewensmëttel an Ärer Ernärung ze enthalen. Fir de Kierper ass Protein dat Haaptgebai! Zesumme mat reegelméissegen Training, hëlleft et Iech e schéine atletesche Kierper opzebauen!
Proteine sinn déi wichtegst chemesch Verbindungen, ouni déi déi vital Aktivitéit vum Kierper onméiglech wier. Proteine bestinn aus Enzymen, Zellen vun Organer, Stoffer. Si sinn verantwortlech fir de metaboleschen, den Transport a vill aner Prozesser, déi am mënschleche Kierper stattfannen. Proteine kënnen net "a Reserve" accumuléieren, dofir musse se reegelméisseg ingoss ginn. Si si besonnesch wichteg fir Leit déi am Sport involvéiert sinn, well Proteine geregelt sinn.
Organisatioun Niveauen

De K. Lindstrom-Lang huet proposéiert fir 4 Niveaue vun der struktureller Organisatioun vu Proteine z'ënnerscheeden: primär, sekundär, tertiär a quaternär Strukturen. Och wann dës Divisioun e bësse verännert ass, gëtt se awer weider benotzt. Déi primär Struktur (Sequenz vun Aminosauerreschter) vun engem Polypeptid gëtt festgeluecht duerch d'Struktur vu sengem Gen a genetesche Code, a Strukture vu méi héije Uerder ginn am Proteinfolding geformt. Och wann déi raimlech Struktur vum Protein als Ganzt duerch seng Aminosauer Sequenz bestëmmt gëtt, ass et zimmlech labber a kann ofhängeg vun externe Bedingunge sinn, dofir ass et méi korrekt ze schwätzen iwwer déi bevorzugt oder energesch favorabel Proteinkonformatioun.
Primär Struktur

Déi primär Struktur ass d'Sekvens vun Aminosauerreschter an der Polypeptid Kette. Déi primär Struktur vun engem Protein gëtt typesch beschriwwen mat eenzel oder dräi Buschtsbezeechnunge fir Aminosauerreschter.
Wichteg Charakteristike vun der primärer Struktur si konservativ Motiver - stabil Kombinatioune vun Aminosauerreschter, déi eng gewësse Funktioun ausféieren an a ville Proteine fonnt ginn. Konservativ Motiver gi wärend der Evolutioun vun Spezies bewahrt, et ass oft méiglech d’Funktioun vun engem onbekannte Protein vun hinnen virauszesoen. De Grad vun Homologie (Ähnlechkeet) vun den Aminosauer Sequenzen vun de Proteine vu verschidden Organismen kann benotzt ginn fir d'evolutiv Distanz tëscht den Taxa ze bewäerten, zu deem dës Organismen gehéieren.
Déi primär Struktur vun engem Protein kann duerch Proteinsekvenséierungsmethoden oder duerch déi primär Struktur vu sengem mRNA mat der genetescher Code Tabelle bestëmmt ginn.
Sekondär Struktur
Déi sekundär Struktur ass déi lokal Uerdnung vun engem Fragment vun enger Polypeptid Kette stabiliséiert duerch Waasserstoffbänn.Folgend sinn déi meescht üblech Aarte vu sekundärer Proteinstruktur:
- α-Hellefe sinn dichte Wendungen ëm déi laang Achs vum Molekül. Ee Wendung ass 3,6 Aminosauerreschter, d'Helixquote ass 0,54 nm (0,15 nm fällt op engem Aminosaierreschter). D'Spiral ass duerch Waasserstoffbindungen tëscht den H an O-Peptidgruppen stabiliséiert, mat 4 Eenheeten ausenee verdeelt. Och wann den α-Helix entweder lénkshändeg oder rechtshändeg kann sinn, predominéiert riets-Hand an Proteinen. D'Spiral gëtt duerch d'elektrostatesch Interaktioune vu Glutaminsäure, Lysin, Arginin gestéiert. Nëmme matenee Spargelen, Serine, Threonin a Leucinreschter kënnen steresch mat der Bildung vun der Helix stéieren, Prolinreschter verursaache Kette béien an och α-Helikopter stéieren,
- ß-Placke (geklappte Schichten) sinn e puer Zickzack-Polypeptid Ketten, an deenen Waasserstoffbindungen entstinn tëscht relativ wäit ewech vuneneen (0,34 nm pro Aminosaierreschter) Aminosäuren an der primärer Struktur oder verschidde Proteinketten (anstatt eng gutt verbrennt, wéi dat de Fall ass an der α-Helix sinn). Dës Ketten ginn normalerweis vun den N-Enden an entgéintgesate Richtungen (antiparallel Ausriichtung) oder an enger Richtung (parallel ß-Struktur) geriicht. Et ass och méiglech d'Existenz vun enger gemëschter ß-Struktur, déi aus parallelen an antiparallellen ß-Strukturen besteet. Fir d'Bildung vun β-Blieder, kleng Gréissten vun de Säitegruppe vun Aminosaieren sinn wichteg, normalerweis Glycin an Alanin predominéieren,
- π-Helix
- 310spiralen
- unordered Fragmenter.
Tertiär Struktur

Déi tertiär Struktur ass déi raimlech Struktur vun der Polypeptid Kette. Strukturell besteet et aus Elementer vun enger sekundärer Struktur, stabiliséiert vu verschiddenen Zorten vun Interaktiounen, an deenen hydrophobesch Interaktioune eng entscheedend Roll spillen. D'Stabiliséierung vun der tertiärer Struktur beinhalt:
- kovalente Obligatiounen (tëscht deenen zwee Cysteinreschter - Disulfidbrécke),
- ionesch Obligatiounen tëscht oppositéiert gelueden Säitegruppe vun Aminosaierreschter,
- Waasserstoff Obligatiounen
- hydrophobesch Interaktiounen. Wann Dir mat de Ëmgéigend Waassermolekülle interagéiert, gëtt de Proteinmolekül geklappt sou datt d'onpolar Säitegruppe vun Aminosäuren aus der wässerlecher Léisung isoléiert sinn, a polar hydrophile Säitegruppen erschéngen op der Uewerfläch vum Molekül.
Studie vun de Grondsätz vun der Proteinenfaltung huet gewisen datt et bequem ass en aneren Niveau ze z'ënnerscheeden tëscht dem Niveau vun der sekundärer Struktur an der atomarer Raumstruktur - dem Klappmotiv (Architektur, Strukturmotiv). D'Stylingmotiv gëtt duerch déi géigesäiteg Arrangement vun de sekundäre Strukturelementer (α-Helices an β-Strenge) am Protein Domain bestëmmt - eng kompakt Globus déi entweder vu sech selwer existéiere kann oder en Deel vun engem méi grousse Protein zesumme mat anere Beräicher kann sinn. Betruecht zum Beispill ee vun de charakteristesche Motiver vun der Struktur vu Proteinen. De kugelfërmege Protein an der Figur uewe riets gewisen, triose Phosphatisomerase, huet e Klappmotiv mam α / β Zylinder genannt: 8 parallel β Sträng bilden en ß Zylinder an engem aneren Zylinder, besteet aus 8 α-Helicen. Dëst Motiv gëtt a ronn 10% Proteine fonnt.
Et ass bekannt datt Stylingmotiver zimmlech konservativ sinn an a Proteine fonnt ginn, déi weder funktionell nach evolutiv Relatiounen hunn. Identifikatioun vu Klappmotiv ënnersträicht déi kierperlech oder rational Klassifikatioun vu Proteinen (wéi CATH oder SCOP).
Fir déi raimlech Struktur vum Protein ze bestëmmen, ginn Methode vun der Röntgendiffraktiounsanalyse, nuklear magnetesch Resonanz an e puer Aarte vu Mikroskopie benotzt.
Quaternary Struktur
D'Véierstruktur (oder Ënnerunitéit, Domain) ass déi géigesäiteg Arrangement vu verschiddene Polypeptidketten an engem eenzege Protein Komplex.D'Proteinmoleküle, déi de Protein mat der quaternärer Struktur ausmaachen, gi getrennt op de Ribosomen geformt an eréischt nom Enn vun der Synthes bilden se eng gemeinsam supramolekulär Struktur. E quaternäre Protein kann souwuel identesch a verschidde Polypeptidketten enthalen. D'Stabiliséierung vun der Quaternary Struktur beinhalt déiselwecht Aarte vun Interaktiounen wéi an der Stabiliséierung vun der Tertiär. Supramolecular Protein Komplexe kënnen aus Dosende vu Molekülle bestoen.
Klassifikatioun no Zort Gebai
No der allgemenger Zort Struktur kënnen Proteine an dräi Gruppen opgedeelt ginn:
- Fibrillär Proteine - bilden Polymeren, hir Struktur ass normalerweis héich reegelméisseg a gëtt haaptsächlech duerch Interaktioune tëscht verschiddene Ketten ënnerstëtzt. Si bilden Mikrofilamenter, Mikrotubulen, Fibrillen, an ënnerstëtzen d'Struktur vun Zellen a Stoffer. Fibrillar Proteine enthalen Keratin a Kollagen.
- Globular Proteine si Waasserléislech, déi allgemeng Form vun der Molekül ass méi oder manner sphäresch.
- Membranproteine - hu Beräicher déi d'Zellmembran schneiden, awer Deeler vun hinnen stiechen aus der Membran an d'interzellulär Ëmfeld an d'Zellzytoplasma. Membranproteine wierken als Rezeptoren, dat heescht, se vermëttelen Signaler, a bidden och e transmembrane Transport vu verschiddene Substanzen. Proteintransporter si spezifesch, jidderee passéiert duerch d'Membran nëmmen bestëmmte Molekülen oder e bestëmmten Typ Signal.
Einfach a komplex Proteinen
Zousätzlech zu Peptidketten enthalen vill Proteinen och Net-Aminosaier Gruppen, an no dësem Critère ginn Proteinen an zwou grouss Gruppen opgedeelt - einfach a komplex Proteinen (Proteiden). Einfach Proteine besteet nëmmen aus Polypeptid Ketten, komplex Proteine enthalen och net-Aminosaier, oder prothetesch, Gruppen. Ofhängeg vun der chemescher Natur vun de prostetesche Gruppen, ginn déi folgend Klassen ënner komplexe Proteine ënnerscheet:
- Glycoproteine enthale kovalent verbonne Kohbhydratreschter als Prothetikgrupp, Glycoproteine enthalen mucopolysaccharide Reschter gehéieren zu der Ënnerklass vu proteoglycans. Hydroxylgruppen vu Serin oder Threonin sinn normalerweis an der Bildung vun enger Bindung mat Kohlenhydratreschter involvéiert. Déi meescht extrazellulär Proteine, besonnesch Immunoglobuline, si Glykoproteine. A proteoglycans ass de Kuelenhydrater Deel
95% vun der Gesamtmass vun der Proteinmolekül, si sinn d'Haaptkomponent vun der interzellularer Matrix,
2. Déi biologesch Bedeitung vun der Reproduktioun vun Organismen. Reproduktiounsmethoden.
1. Reproduktioun a seng Bedeitung.
Reproduktioun - Reproduktioun vun ähnlechen Organismen, déi suergt
d'Existenz vun Arten fir vill Joerdausend dréit zur Erhéijung vun
d'Zuel vun Individuen vun der Spezies, d'Kontinuitéit vum Liewen. Asexuell, sexuell a
vegetativ Ausbreedung vun Organismen.
2. Asexuell Reproduktioun ass den eelste Wee. An
een Organismus ass u Sexualitéit involvéiert, wärend dacks an der sexueller deelhuelen
zwee Personnagen. A Planzen, asexuell Reproduktioun mat Spore - eng
spezialiséiert Zellen. Verbreedung duerch Spore vun Algen, Moos, Päerdsail,
plunder, Fernen. Ausschlag vu Spore vu Planzen, hir Keimung an Entwécklung vun
hinnen nei Filialorganismen an gënschtege Konditioune. Doud vun enger riseger Zuel
Sträit falen an gënschteg Konditiounen. Niddereg Probabilitéit vum Optriede
nei Organismen aus Spore well se wéineg Nährstoffer enthalen an
der seedling absorbéiert se haaptsächlech aus der Ëmwelt.
3. Vegetativ Ausbreedung - Ausbreedung vu Planzen mat
vegetativ Organer benotzen: Loft- oder ënnerierdesch Seancen, Deeler vun der Wurzel,
Blat, Knollen, Knollen. Participatioun un der vegetativer Ausbreedung vun engem Organismus
oder Deeler dovun. D'Offinitéit vun der Duechterplanz mat der Mamm, sou wéi et
weider d'Entwécklung vum Kierper vun der Mamm. Grouss Effizienz an
d'Verbreedung vu vegetativen Ausbreedung an der Natur, als Duechtergesellschaft
méi séier aus dem maternalen Deel geformt wéi aus der Spore. Vegetative Beispiller
Zucht: Rhizome benotzen - Lilie vum Dall, Mënz, Weessgras, asw., Wuerzelen
niddereg Branchen de Buedem beréieren (Schichtung) - Kréichelen, wilde Drauwe, Moustache
- Äerdbier, Knollen - Tulpen, Narzissen, Krokus. Benotzung vu vegetativ
breet wann kultivéiert Planzen wuessen: Gromperen gi propagéiert duerch Knollen,
Knollen - Zwiebelen a Knuewel, Schichten - Johannisbeeren a Kräizerbeeren, Root
Nokomme - Kirsch, Plum, Tresor - Uebstbeem.
4. Sexuell Reproduktioun. D'Essenz vun der sexueller Reproduktioun
bei der Bildung vu Keimzellen (Gameten), d'Fusioun vun der männlecher Keimzell
(Spermien) a Fra (Ee) - Befruchtung an d'Entwécklung vun engem Neien
eng Duechterorganismus aus engem befruchtten Ee. Dank der Befruchtung
en subsidiäre Organismus mat engem méi diversen Set vu Chromosomen, wat heescht mat méi
verschidde Ierfschirmer, doduerch kann et ausgesinn
méi ugepasst un de Liewensraum. D'Präsenz vu sexueller Reproduktioun an
algen, Moos, Fernen, Gymnospermen an Angiospermen. Komplikatioun
de sexuellen Prozess an Planzen während hirer Evolutioun, d'Erscheinung vun de komplexsten
a Formen a Saamplanzen.
5. Seedegerechtung geschitt mat der Hëllef vu Somen,
et ass charakteristesch fir Gymnospermen an Angiospermen (Angiospermen
vegetativ Ausbreedung ass och verbreet). Sequenz vu Schrëtt
seed propagation: Pollinatioun - Transfer vu Pollen op de Stigma vun engem Pistil, säi
germination, Entstoe andeems se zwee Spermien deelen, hir Fortschrëtter an
ovule, dann d'Fusioun vun engem Spermien mat engem Ee, an deen aneren mat
sekundäre Käre (an Angiospermen). Bildung vun der Eierstull -
den Embryo mat enger Versuergung vun Nährstoffer, an aus de Maueren vum Eierstock - de Fetus. Seed -
de Keim vun enger neier Planz, bei gënschtege Konditioune, spréisst en déi éischte Kéier
seedling gëtt duerch d'Nährstoffer vum Saat, an dann hir Wuerzelen gefüttert
fänken un, Waasser a Mineralstoffer aus dem Buedem ze absorbéieren, an d'Blieder - Kuelendioxid
Gas aus der Loft am Sonneliicht. Dat onofhängegt Liewen vun enger neier Planz.
Protein Biophysik
Kierperlech Eegeschafte vum Protein an der Zell, berücksichtegt d'Waassermembran an d'Verréckelung vu Makromolekülen (eng.) ganz komplizéiert. D'Hypothese vun engem Protein als e bestallten "kristallähnleche System" - en "aperiodesche Kristall" - gëtt ënnerstëtzt duerch Röntgendiffraktiounsanalyse (bis zu enger Resolutioun vun 1 Angstrom), héijer Packendicht, Kooperativitéit vum Denaturatiounsprozess an aner Fakten.
Zugonschte vun enger anerer Hypothese sinn déi flëssegähnlech Eegeschafte vu Proteinen an de Prozesser vun intraglobuläre Bewegungen (Modell vu limitéierter Hopp oder kontinuéierter Diffusioun) bewisen duerch Experimenter op Neutronestreeung, Mössbauer Spektroskopie.

Universal Method: ribosomal Synthese
Proteine ginn synthetiséiert vun liewegen Organismen aus Aminosaieren op Basis vun Informatiounen déi an Genen kodéiert sinn. All Protein besteet aus enger eenzegaarteger Sequenz vun Aminosaierreschter, déi bestëmmt gëtt duerch d'Nukleotidsekwenz vum Gen dat de Protein kodéiert. De genetesche Code ass eng Method fir d'Nukleotid-Sequenz vun DNA (iwwer RNA) an d'Aminosaiersequenz vun enger Polypeptidskette ze iwwersetzen. Dëse Code bestëmmt d'Korrespondenz vun Trinucleotid Sektioune vu RNA, genannt Codons, a gewësse Aminosaieren, déi am Protein enthale sinn: d'AUG Nukleotid Sequenz, zum Beispill, entsprécht Methionin. Zënter datt DNA aus véier Arten vun Nukleotiden besteet, ass d'total Zuel vu méigleche Kodonen 64, a well 20 Aminosaieren a Proteine benotzt ginn, gi vill Aminosäuren duerch méi wéi ee Codon bestëmmt. Dräi Kodone sinn net wichteg: Si déngen als Stoppsignaler fir d'Synthese vun der Polypeptid Kette a ginn Termingskodonen, oder Stopkodonen genannt.
Genen, déi Kodéierungsproteine ginn, ginn als éischt an d'Nukleotid-Sequenz vu Messenger RNA (mRNA) duerch RNA-Polymerase-Enzyme transkribert. An der grousser Majoritéit vu Fäll sinn d'Proteine vu liewegen Organismen op Ribosomen synthetiséiert - multikomponent molekulare Maschinnen, déi am Zytoplasma vun Zellen präsent sinn. De Prozess vun der Synthetiséierung vun enger Polypeptid Kette duerch e Ribosome an enger mRNA Matrix gëtt Iwwersetzung genannt.
D'Ribosomal Proteinsynthese ass grondsätzlech d'selwecht bei Prokaryoten an Eukaryoten, awer ënnerscheet sech a verschiddenen Detailer. Also kann prokaryotesch mRNA duerch Ribosomen an der Aminosauer Sequenz vu Proteine gelies ginn direkt no der Transkriptioun oder och scho virun der Fäerdegstellung. An Eukaryoten muss de primäre Transkript fir d'éischt duerch eng Serie vu Modifikatioune goen an an den Zytoplasma plënneren (op d'Positioun vum Ribosom), ier d'Iwwersetzung kann ufänken. Den Taux vun der Proteinsynthese ass méi héich bei de Prokaryoten a kann 20 Aminosäuren pro Sekonn erreechen.

Och virum Ufank vun der Iwwersetzung befestigen d'Aminoacyl-tRNA Synthetase-Enzyme speziell Aminosaieren op hir entspriechend Transport RNA (tRNA). Eng Regioun vun tRNA, genannt en Anticodon, kann komplementär mat engem mRNA Codon pare, an doduerch d'Inklusioun vun engem Aminosauerreschter, deen un der tRNA befestegt ass an der Polypeptid Kette am Aklang mat dem genetesche Code garantéieren.
Wärend der éischter Etapp vun der Iwwersetzung, der Initiatioun, gëtt den Initiator (normalerweis Methionin) Codon duerch de klengen Ënnerunit vum Ribosom erkannt, un deem en aminoacyléierte Methionin tRNA mat Protein Faktoren vun der Initiatioun verbonne gëtt. Nodeem de Startkodon erkannt ass, trëtt de groussen Ënnerunit de klengen Ënnerunit vum Ribosome un, an déi zweet Stuf vun der Iwwersetzung, der Vergréisserung, fänkt un. Op all Etapp vum Ribosome vum 5'- bis 3'-Enn vum mRNA gëtt ee Codon gelies andeems Waasserstoffverbänn tëscht him an dem Transport-RNA komplementar geformt ass, un deem d'entspriechend Aminosauerreste verbonne sinn. D'Bildung vun enger Peptidbindung tëscht dem leschten Aminosaierreschter vum wuessende Peptid an der Aminosauerreschter, déi mat der tRNA befestegt ass, gëtt duerch ribosomal RNA (rRNA) katalyséiert, wat de Peptidyltransferaszentrum vum Ribosom bildt. Dësen Zentrum positionéiert d'Stickstoff a Kuelestoffatome an enger Positioun déi favorabel fir d'Passage vun der Reaktioun ass. Déi drëtt an lescht Etapp vun der Iwwersetzung, der Terminéierung, geschitt wann de Ribosome de Stoppkodon erreecht, no deem Protein-Terminéierungsfaktoren de Verbindung tëscht der leschter tRNA an der Polypeptid Kette hydrolyséieren, seng Synthese stoppen. An Ribosomen ginn Proteine ëmmer aus der N- an den C-Uschloss synthetiséiert.
Neribosomal Synthese
Bei nidderegen Pilze an e puer Bakterien ass eng zousätzlech (net-ribosomal, oder multienzyme) Method vun der Biosynthese vu Peptiden bekannt, normalerweis vun enger klenger an ongewéinlecher Struktur.D'Synthese vun dësen Peptiden, normalerweis sekundär Metaboliten, gëtt duerch en héije Molekulargewiicht Protein Komplex, NRS Synthas, duerchgefouert ouni déi direkt Participatioun vu Ribosomen. NRS Synthase besteet normalerweis aus verschiddenen Domainen oder eenzel Proteinen déi Aminosaieren auswielen, eng Peptidbindung bilden an e synthetiséiert Peptid fräigeloossen. Zesummen sinn dës Domänen de Modul. All Modul garantéiert d'Inklusioun vun enger Aminosaier am synthetiséiertem Peptid. NRS Synthasen kënnen also aus een oder méi Moduler zesummesetze sinn. Heiansdo enthält dës Komplexe en Domän deen fäeg ass L-Aminosaieren (normal Form) an eng D-Form ze isomeriséieren.
Chemesch Synthese
Kuerz Proteine kënnen chemesch mat Methoden vun der organescher Synthese synthetiséiert ginn, zum Beispill, chemesch Ligatioun. Déi meescht Oft passéiert d'chemesch Synthese vum Peptid an der Richtung vum C-Enn bis den N-Enn, am Géigesaz zu der Biosynthese op Ribosomen. D'Method vun der chemescher Synthese produzéiert kuerz immunogen Peptiden (Epitopen), déi dann an Déieren injizéiert ginn fir spezifesch Antikörper oder Hybridome ze kréien. Ausserdeem gëtt dës Method och benotzt fir Inhibitoren vu gewëssen Enzymen ze kréien. Chemesch Synthese erméiglecht d'Aféierung vun Aminosauerreschter, déi net a konventionell Proteine fonnt ginn, zum Beispill déi mat Fluoreszenzetiketten op hir Säiteketten befestegt. Chemesch Methoden fir d'Synthese vu Proteinen hu verschidden Aschränkungen: si sinn net effikass mat enger Proteinlängt vu méi wéi 300 Aminosauerreschter, künstlech synthetiséiert Proteine kënnen eng onregelméisseg tertiär Struktur hunn a feelen charakteristesch post-translational Modifikatioune (kuckt hei ënnendrënner).
Post-Iwwersetzungsännerung

Nodeem d'Iwwersetzung ofgeschloss ass, gi meescht Proteine weider chemesch Modifikatioune genannt post-translational Modifikatioune. Méi wéi zweehonnert Varianten vu post-translationelle Modifikatioune vu Proteine si bekannt.
Post-Iwwersetzungsmodifikatioune kënnen d'Liewensdauer vu Proteinen an der Zell regelen, hir enzymatesch Aktivitéit an Interaktioune mat anere Proteinen. An e puer Fäll, post-translational Modifikatioune sinn eng obligatoresch Etapp vun der Protein Reifung, soss ass et funktionell inaktiv. Zum Beispill, mat der Reifung vum Insulin an e puer aner Hormonen, ass limitéiert Proteolyse vun der Polypeptid Kette erfuerderlech, a mat der Reifung vu Plasma Membranproteine ass Glykosylatioun erfuerderlech.
Post-Iwwersetzungsmodifikatioune kënne souwuel verbreet a seelen sinn, bis zu eenzegaartegem. E Beispill vun enger universeller Modifikatioun ass Ubiquitinatioun (Befestegung vun enger Kette vu verschiddene Molekülle vum kuerzen Ubiquitin Protein zu engem Protein), wat als Signal fir d'Spaltung vun dësem Protein vum Proteasom déngt. Eng aner gemeinsam Modifikatioun ass Glykosyléierung - et gëtt geschat datt ongeféier d'Halschent vun de mënschleche Proteinen glycosyléiert sinn. Selten Ännerungen enthalen Tyrosinéierung / Detirozinatioun a Polyglycyléierung vum Tubulin.
Een an datselwecht Protein ka vill Verännerunge maachen. Also Histone (Proteinen déi Deel vu Chromatin an Eukaryoten sinn) ënner verschiddene Konditioune kënne méi wéi 150 verschidde Verännerunge maachen.
Post-Iwwersetzungsännerunge sinn opgedeelt an:
- Haaptkrees Ännerungen,
- Spaltung vum N-terminalen Methioninreschter,
- limitéiert Proteolyse - Entfernung vun engem Proteinfragment dat aus den Enden optriede kann (Splitting vun Signalsekvensen) oder, an e puer Fäll, an der Mëtt vum Molekül (Insulin Reifung),
- d'Befestegung vu verschiddene chemesche Gruppen u fräien Amino- a Carboxylgruppen (N-Acylatioun, Myristoylatioun, asw.),
- Ännerunge vun de Säiteketten vun Aminosaieren,
- d'Zousatz oder d'Spaltung vu klenge chemesche Gruppen (Glykosyléierung, Phosphorylatioun, asw.)
- d'Zousatz vun Lipiden a Kuelestoff,
- Ännerung vun normalen Aminosauerreschter um Net-Standard (d'Bildung vu Citrulline),
- d'Bildung vu Disulfidbrécke tëscht Cysteinreschter,
- d'Zousatz vu klenge Proteinen (Sumoylatioun an Ubiquitinatioun).
Intracellular Transport a Sortéierung
D'Proteinen, déi am Zytoplasma vun enger eukaryotescher Zell synthetiséiert sinn, musse mat verschiddene Zellorganoiden transportéiert ginn: de Kär, d'Mitochondrien, den endoplasmesche Retikulum (EPR), de Golgi-Apparat, de Lysosomen, asw., An e puer Proteine mussen an dat extrazellulart Medium dran. Fir an eng gewësse Sektioun vun der Zell z'erreechen, muss de Protein e spezifescht Label hunn. An deene meeschte Fäll ass sou e Label Deel vun der Aminosauer Sequenz vum Protein selwer (Leader Peptid, oder Signalsequenz vum Protein), awer an e puer Fäll sinn d'Oligosacchariden, déi dem Protein befestegt sinn, de Label.
D'Transport vu Proteinen an der EPR gëtt duerchgefouert well se synthetiséiert sinn, well d'Ribosomen déi Proteine mat enger Signalsequenz fir den EPR "sëtzen" op speziellen Proteinen op senger bausseger Membran. Vun der EPR zum Golgi Apparat, a vun do an de Lysosomen an an d'extern Membran oder an dat extrazellulärt Medium, ginn Proteine via vesikulär Transport eran. Proteine mat engem nuklearen Lokaliséierungssignal ginn an de Kärel duerch Nuklearporen. A Mitochondrien a Chloroplaste ginn Proteine, déi déi entspriechend Signalsequenzen hunn, duerch spezifesch Protein Iwwersetzer Poren mat der Participatioun vu Chaperonen.
Struktur an Degradatioun erhalen
Déi korrekt raimlech Struktur vu Proteinen erhalen ass entscheedend fir hiren normale Fonctionnement. Falsch ausklappen vun Proteinen, déi zu hirer Aggregatioun féieren, kënne verursaacht ginn duerch Mutatiounen, Oxidatioun, Stressbedingunge oder global Verännerungen an der Physiologie vun der Zell. Aggregatioun vu Proteinen ass e charakteristesche Zeechen vun der Alterung. Et gëtt ugeholl datt falsch Proteinfaltung d'Ursaach oder d'Vergréisserung vu Krankheeten ass wéi zystesch Fibrose, lysosomal Akkumulation Krankheet. souwéi neurodegenerativ Stéierungen (Alzheimer, Huntington a Parkinson).
Am Prozess vun der Zell Evolutioun goufen véier Haaptmechanismen entwéckelt fir Proteinaggregatioun entgéintwierken. Déi éischt zwee - wiederhuelend ausklappen (refolding) mat der Hëllef vu Chaperonen a Spaltung mat Proteaseen - ginn souwuel a Bakterien wéi an méi héijen Organismen fonnt. Autophagie an d'Akkumulatioun vu falsch gefalteten Proteinen a speziellen net-Membranorganellen sinn charakteristesch fir Eukaryoten.

D'Kapazitéit vu Proteine fir déi richteg dreidimensional Struktur nom Denaturéierung ze restauréieren huet et eis erlaabt ze hypothese datt all Informatioun iwwer d'endgülteg Struktur vum Protein a senger Aminosauer Sequenz enthält. De Moment ass d'Theorie datt déi stabil Konformatioun vun engem Protein minimal fräi Energie huet mat anere méigleche Konformatiounen vun dësem Polypeptid verglach.
An den Zellen gëtt et eng Grupp vu Proteinen, deenen hir Aufgab ass déi korrekt Ausklappung vun anere Proteinen no hirer Synthese um Ribosom ze garantéieren, d'Struktur vu Proteinen no hirem Schued ze restauréieren, souwéi d'Schafung an d'Dissoziatioun vun Proteinkomplexen. Dës Proteine ginn Chaperone genannt. D'Konzentratioun vu ville Chaperonen an der Zell hëlt mat enger schaarfer Erhéijung vun der Ëmfeldtemperatur, sou datt se zu der Hsp Grupp gehéieren (Englesch Wärmschockproteine - Hëtzschockproteinen). D'Wichtegkeet vum normale Funktionéiere vu Chaperonen fir de Fonctionnement vum Kierper kann illustréiert ginn duerch d'Beispill vun α-kristallin Chaperon, deen Deel vun der Lens vum mënschlechen Auge ass. Mutatiounen an dësem Protein féieren zur Verschäerfung vun der Lens wéinst der Aggregatioun vu Proteinen an als Resultat zu Katarakt.
Wann déi tertiär Struktur vu Proteine net restauréiere kënnt, gi se vun der Zell zerstéiert. Enzymer, déi Proteine degradéieren, gi Proteasë genannt.Op der Plaz vum Attack vum Substratmolekül, ginn proteolytesch Enzyme an Endopeptidasen an Exopeptidasen opgedeelt:
- Endopeptidasen, oder Proteinasen, spaltéiere Peptidbindungen bannent der Peptidkette. Si erkennen a binden kuerz Peptid-Sequenze vu Substrater a relativ spezifesch hydrolyséieren d'Bänn tëscht bestëmmten Aminosauerreschter.
- Exopeptidases hydrolyséiere Peptiden aus den Enden vun der Kette: Aminopeptidasen aus dem N-Uschloss, Carboxypeptidasen aus dem C-Uschloss. Schlussendlech schneiden dipeptidases nëmmen Dipeptiden.
Geméiss dem Katalysemechanismus identifizéiert d'international Unioun fir Biochemie a Molekulär Biologie verschidde Klassen vu Proteasen, dorënner serinesch Proteasen, aspartesch Proteaseen, Cysteinproteasen, a Metalloproteasen.
Eng speziell Aart vu Protease ass de Proteasome, e grousse Multisubunit Protease präsent am Käre an Zytoplasma vun Eukaryoten, Archaea, an e puer Bakterien.
Fir datt den Zilprotein vum Proteasom geklot gëtt, muss et bezeechent ginn andeems e klengen Ubiquitin Protein anhëllt. D'Additiounsreaktioun vum Ubiquitin gëtt duerch d'Enzyme ubiquitin Ligasen katalyséiert. D'Zousatz vum éischten Ubiquitin Molekül zum Protein déngt als Signal fir Ligasen fir déi weider Zousatz vun Ubiquitin Molekülen. Als Resultat ass eng Polyubiquitin Kette un de Protein befestegt, wat un de Proteasom bindt a gespléckt vum Zilprotein. Allgemeng ass dëst System ubiquitin-ofhängeg Protein Degradatioun genannt. D'Degradatioun vun 80–90% vun intrazelluläre Proteinen geschitt mat der Participatioun vum Proteasom.
Protein Degradatioun an Peroxisomen ass wichteg fir vill cellulär Prozesser, dorënner den Zellzyklus, d'Reguléierung vum Genausdrock, an d'Äntwert op oxidativen Stress.

Autophagie ass de Prozess vun der Degradatioun vu laangliewege Biomoleküle, besonnesch Proteinen, souwéi Organellen a Lysosomen (bei Säugedéieren) oder Vakuoler (a Hef). Autophagie begleet déi vital Aktivitéit vun all normaler Zell, awer de Mangel u Nährstoffer, d'Präsenz vu beschiedegt Organellen am Zytoplasma an, schliisslech, d'Präsenz vun deelweis denaturéiert Proteinen an hir Aggregaten am Zytoplasma kënne als Stimulatioun déngen fir d'Prozesser vun der Autophagie an Zellen ze verbesseren.
Dräi Aarte vu Autophagie ginn ënnerscheet: Mikroautophagie, Makroautophagie, a Chaperon-ofhängeg Autophagie.
Wärend der Mikroautophagie ginn Makromolekülle a Fragmenter vun Zellmembranen duerch de Lysosom ageholl. Op dës Manéier kann d'Zell Proteine mat engem Mangel un Energie oder Baustoff verdaut ginn (zum Beispill während der Hongerung). Awer d'Prozesser vu Mikroautophagie passéieren ënner normalen Bedingungen a si meeschtens indiskriminéierend. Heiansdo ginn Organoiden och verdaut wärend der Mikroautophagie, zum Beispill, Mikroautophagie vu Peroxisome a partiell Mikroautophagie vu Käre, an deenen d'Zelle liewensfäeg bleift ass a Geste beschriwwen.
An der Makroautophagie ass en Deel vum Zytoplasma (dacks mat iergendenger Organoiden) ëmginn vun engem Membrancompartiment ähnlech wéi e Wëld vum endoplasmatesche Retikulum. Als Resultat gëtt dëse Site vun de Rescht vum Zytoplasma duerch zwee Membren getrennt. Esou Duebelmembranorganelle ginn Autophagosome genannt. Autophagosome fusionéiere mat Lysosomen, bilden Autophagolysosome, an deenen Organellen an de Rescht vun den Inhalter vun Autophagosome verdaut ginn. Anscheinend ass d'Makroautophagie och net selektiv, obwuel et dacks betount gëtt datt mat der Hëllef d'Zelle vun Organoiden lass ka ginn, déi "ausgelooss hunn" (Mitochondrien, Ribosomen, etc.).
Déi drëtt Zort Autophagie ass chaperonofhängeg. An dëser Method fënnt en direkten Transport vun deelweis denaturéierten Proteinen aus dem Zytoplasma duerch de Lysosommembran op seng Kavitéit, wou se verdaut ginn. Dës Aart vun Autophagie, beschriwwen nëmmen bei Mamendéieren, gëtt vu Stress induzéiert.

JUNQ an IPOD
Ënnert Stress, wann eng eukaryotesch Zell net mat der Akkumulation vun enger grousser Zuel vun denaturéierten Proteine ka klappen, kënne se op eng vun zwou Aarte vun temporärer Organelle geschéckt ginn - JUNQ an IPOD (Englesch) Russesch. An.
JUNQ (Eng. JUxta Nuclear Quality Control compartment) ass mat der äusser Säit vun der nuklearer Membran verbonne ginn an enthält ubiquitinéiert Proteinen déi séier an den Zytoplasma iwwerdroe kënne ginn, souwéi Chaperonen a Proteasomen. Déi virgesinn Funktioun vum JUNQ ass d'Refolde an / oder Degradéiere vu Proteinen.
IPOD (Englesch Insoluble Protein Deposit - eng Plaz vun Oflagerung vun insoluble Proteinen) läit an der Géigend vum zentrale Vakuol a enthält immobile Aggregate vun amyloid-bildende Proteinen. D'Akkumulation vun dëse Proteinen an der IPOD kann hir Interaktioun mat normale celluläre Strukturen verhënneren, dofir gëtt ugeholl datt dës Inklusioun eng Schutzfunktioun huet.
D'Funktioune vu Proteinen am Kierper
Wéi aner biologesch Makromolekülen (Polysacchariden, Lipiden an Nukleinsäuren) sinn Proteine wesentlech Bestanddeeler vun all liewegen Organismen a spillen eng wichteg Roll am Liewen vun der Zell. Proteine maachen metabolesche Prozesser. Si gehéieren zu intrazelluläre Strukturen - Organellen an Zytoskeleton, ausgeschloss an den extrazelluläre Raum, wou se als Signal tëscht den Zellen iwwerdroe kënnen optrieden, un der Hydrolyse vum Iessen an der Bildung vun der interzellularer Substanz deelhuelen.
D'Klassifikatioun vu Proteine no hire Funktiounen ass zimmlech arbiträr, well deeselwechte Protein verschidde Funktiounen ausféiere kann. E gutt studéiert Beispill vun esou Multifunktionalitéit ass Lysyl tRNA Synthetase, en Enzym aus der Klass vun Aminoacyl tRNA Synthetasen, déi net nëmmen de Lysinreschter op tRNA befestegt, awer och d'Transkriptioun vu verschidde Genen regléiert. Proteine maachen vill Funktiounen wéinst hirer enzymatescher Aktivitéit. Also, d'Enzyme si Myosin Motor Protein, regulatorescht Proteinkinase Proteinen, Transportprotein Natrium-Kalium Adenosin Triphosfatase, etc.

Katalysesch Funktioun
Déi bekanntst Funktioun vu Proteinen am Kierper ass d'Katalyse vu verschiddene chemesche Reaktiounen. Enzymer si Proteine mat spezifesche katalyteschen Eegeschaften, dat heescht, all Enzym katalyséiert eng oder méi ähnlech Reaktiounen. Enzymer katalyséieren d'Spaltung vu komplexe Molekülle (Katabolismus) an hir Synthese (Anabolismus), dorënner DNA Replikatioun a Reparatur a Matrix RNA Synthese. Bis 2013 goufen iwwer 5.000 Enzymen beschriwwen. D'Beschleunegung vun der Reaktioun als Resultat vun der enzymatescher Katalyse kann enorm sinn: d'Reaktioun katalyséiert duerch den Enzym Orotidin-5'-Phosphat-Decarboxylase, zum Beispill, geet 10 17 Mol méi séier wéi den net-katalyséierten een (d'Hallefzäit vun der Dekarboxylatioun vun Orotinsäure ass 78 Millioune Joer ouni den Enzym an 18 Millisekonnen). Molekülen, déi sech un dat Enzym befestigen a sech als Resultat vun der Reaktioun änneren, ginn Substrate genannt.
Och wann Enzymer normalerweis aus Honnerte vun Aminosaierreschter besteet, sinn nëmmen eng kleng Ëmwandlung vun hinnen interagéiert mam Substrat, an och méi kleng Quantitéiten - am Duerchschnëtt 3-4 Aminosaierreschter, dacks wäit vuneneen an der primärer Struktur lokaliséiert - sinn direkt un der Katalyse bedeelegt. Deen Deel vun der Enzymmolekül, déi d'Bindung vum Substrat a Katalyse bitt, nennt een den aktiven Zentrum.
Am 1992 huet d'International Union of Biochemistry and Molecular Biology déi lescht Versioun vun der hierarchescher Nomenklatur vun Enzymen proposéiert baséiert op der Aart vu Reaktiounen, déi vun hinnen katalyséiert goufen. Geméiss dëser Nomenklatur mussen d'Nimm vun Enzymen ëmmer en Enn hunn -d'Grondlagen a bilden aus den Nimm vun de katalyséierte Reaktiounen an hir Substrater. All Enzym ass en individuellen Code zougewisen, duerch deen et einfach ass seng Positioun an der Hierarchie vun Enzymen ze bestëmmen.Geméiss der Aart vu katalyséierte Reaktiounen ginn all Enzymen a 6 Klassen opgedeelt:
- CF 1: oxidoreductases, déi Redox Reaktiounen katalyséieren,
- CF 2: Transferases, déi den Transfer vu chemesche Gruppen aus engem Substratmolekül op en anert katalyséieren,
- CF 3: Hydrolase katalyséieren d'Hydrolyse vu chemesche Verbindungen,
- CF 4: Lyases, déi d'Verbrieche vu chemesche Verbindunge katalyséieren ouni Hydrolyse mat der Bildung vun enger Duebelfinanz an engem vun de Produkter,
- CF 5: Isomerasen déi strukturell oder geometresch Ännerungen am Substratmolekül katalyséieren,
- CF 6: Ligasen, déi d'Bildung vu chemesche Verbindungen tëscht Substrate katalyséieren wéinst der Hydrolyse vun der ATP Diphosphatbindung oder engem ähnlechen Triphosphat.
Strukturell Funktioun
Déi strukturell Proteine vum Zytoskelett, als eng Aart Armature, Form Zellen a vill Organoiden a si bedeelegt un der Ännerung vun der Form vun den Zellen. Déi meescht strukturell Proteine si filamentös: Aktin a Tubulin Monomeren sinn zum Beispill kugelfërmegen, opléisleche Proteinen, awer no der Polymeriséierung bilden se laang Strenge, déi den Zytoskelett ausmaachen, wat et erlaabt der Zell Form ze halen. Collagen an Elastin sinn d'Haaptkomponente vun der interzellularer Substanz vum Bindegewebe (zum Beispill, Knorpel), an Hoer, Neel, Vugelfieder an e puer Muschelen besteet aus engem aneren keratin strukturelle Protein.

Schutzfunktioun
Et gi verschidden Aarte vu Schutzfunktioune vu Proteinen:
- Kierperlech Schutz. De kierperleche Schutz vum Kierper gëtt vu Kollagen gesuergt, e Protein dat d'Basis vun der interzellularer Substanz vu Bindegewebe mécht (inklusiv Schanken, Knorpel, Sehnen an déif Schichten vun der Haut (Dermis)), Keratin, dat d'Basis vu geckege Schëlder, Hoer, Fieder, Héieren an aner Derivate vun der Epidermis bildt. Typesch ginn esou Proteine als Proteine mat struktureller Funktioun ugesinn. Beispiller vu Proteine vun dëser Grupp si Fibrinogen an Thrombin involvéiert an der Bluttkoagulatioun.
- Chemesche Schutz. D'Verbindung vun Toxinen un Proteinmoleküle kann hir Entgiftung ubidden. Eng besonnesch wichteg Roll bei Entgiftung bei Mënschen gëtt vu Leber-Enzyme gespillt, déi Gëft ofbriechen oder se an eng opléisbar Form ëmgewandelen, wat zu enger rapider Eliminatioun aus dem Kierper dréit.
- Immune Verdeedegung. Proteinen, déi Blutt ausmaachen an aner Kierperflëssegkeeten sinn an der defensiver Reaktioun vum Kierper béid Schued an Attacke vu Pathogenen involvéiert. Proteine vum Zousazsystem an Antikörper (Immunoglobuline) gehéieren zu de Proteine vun der zweeter Grupp, si neutraliséieren Bakterien, Virussen oder auslännesch Proteine. Antikörper, déi Deel vum adaptiven Immunsystem sinn, befestigen sech un Substanzen, déi am Kierper friem sinn, Antigen, an doduerch neutraliséieren se, se direkt op d'Plaze vun der Zerstéierung. Antikörper kënnen an den interzelluläre Raum geheime ginn oder an de Membranen vu spezialiséierte B-Lymfozyte genannt Plasmozyte fixéiert ginn.
Reguléierungsfunktioun
Vill Prozesser an den Zellen gi vu Proteinmoleküle geregelt, déi weder als Energiequell nach als Baustoffmaterial fir d'Zell déngen. Dës Proteine regelen d'Zellfortschrëtter am Zellzyklus, Transkriptioun, Iwwersetzung, Splicing, d'Aktivitéit vun anere Proteinen, a vill aner Prozesser. Proteine féieren déi regulatoresch Funktioun entweder wéinst enzymatescher Aktivitéit (zum Beispill Proteinkinase), oder wéinst spezifescher Bindung un aner Molekülen. Also, Transkriptiounsfaktoren, Aktivatorproteinen a Repressorproteine kënnen d'Transkriptiounsintensitéit vu Genen reguléieren andeems se un hir regulatoresch Sequenzen binden. Um Iwwersetzungsniveau ass d'Liesen vu ville mRNAs och duerch d'Zousatz vun Protein Faktoren geregelt.
Déi wichtegst Roll bei der Reguléierung vun intrazelluläre Prozesser gëtt vu Proteinkinasen a Proteinphosphatasen gespillt - Enzymer, déi d'Aktivitéit vun anere Proteinen aktivéieren oder hämmen andeems se se befestegt oder d'Sphosphatgruppen ofhänken.

Signal Funktioun
D'Signalfunktioun vu Proteinen ass d'Fäegkeet vu Proteinen als Signalstoffer ze déngen, Signaler tëscht Zellen, Stoffer, Organer an Organismen ze vermëttelen. Oft ass d'Signalfunktioun mat dem reglementaresche kombinéiert, well vill intrazellulär regulatoresch Proteine och Signaler weiderginn.
D'Signaléierungsfunktioun gëtt duerch Hormonproteine gemaach, Zytokine, Wuesstumsfaktoren etc.
Hormone ginn duerch Blutt gedroen. Déi meescht Déierehormone si Proteinen oder Peptiden. D'Verbindung vum Hormon un säin Rezeptor ass e Signal dat eng Zellresprooch ausléist. Hormone reguléieren d'Konzentratioun vu Stoffer am Blutt an Zellen, Wuesstum, Reproduktioun an aner Prozesser. E Beispill vu sou Proteine ass Insulin, wat d'Konzentratioun vu Glukos am Blutt reguléiert.
Zellen interagéiere matenee andeems se Signalproteine, déi duerch d'interzellulär Substanz iwwerdroe ginn. Esou Proteine enthalen zum Beispill Zytokine a Wuesstumsfaktoren.
Cytokine sinn Peptid-Signalmoleküle. Si reguléieren Interaktiounen tëscht Zellen, bestëmmen hir Iwwerliewe, stimuléieren oder hemmt de Wuesstum, Differenzéierung, funktionell Aktivitéit an Apoptose, suerge fir d'Koordinatioun vum Immun, endokrinen an nervös Systemer. E Beispill vu Zytokine ass den Tumor-Nekrose-Faktor, deen entzündlech Signaler tëscht den Zellen vum Kierper iwwerdréit.
Spar (Standby) Funktioun
Esou Proteine enthalen déi sougenannt Reserveproteine, déi als Quell vun Energie a Substanz an de Somen vun de Planzen gespäichert sinn (zum Beispill 7S an 11S Globuline) an Déierer Eeër. Eng Zuel vun anere Proteine ginn am Kierper als Quell vun Aminosaieren benotzt, déi am Viraus sinn Virgänger vu biologesch aktive Substanzen déi metabolesch Prozesser reguléieren.

Receptor Funktioun
Protein Rezeptoren kënnen souwuel am Zytoplasma lokaliséiert ginn an an d'Zellmembran integréieren. Een Deel vun der Rezeptor Molekül kritt e Signal, dat dacks vun enger chemescher Substanz zerwéiert gëtt, an an e puer Fäll - Liicht, mechanesche Stress (zum Beispill, Stretching) an aner Reizen. Wann e Signal un e spezifeschen Deel vum Molekül ausgesat ass - dem Rezeptorprotein - da komme seng Konformatiounsverännerungen op. Als Resultat ännert sech d'Konformatioun vun engem aneren Deel vum Molekül, deen e Signal un aner cellulär Komponenten iwwerdréit. Et gi verschidde Signaliwwerdroungsmechanismen. E puer Rezeptoren katalyséieren eng gewësse chemesch Reaktioun, anerer déngen als Ionkanäl, déi op der Handlung vun engem Signal opmaachen oder zoumaachen, anerer bannen spezifesch intrazellular Mediatiounsmoleküle. Op Membranreceptoren ass deen Deel vum Molekül deen sech un d'Signalmolekül bindt, op der Uewerfläch vun der Zell, an d'Domän, déi d'Signal iwwerdréit, ass dobannen.
Motor (Motor) Funktioun
Eng ganz Klass vu Motorproteine bitt Kierperbeweegunge, zum Beispill, Muskelkontraktioun, inklusiv Lokomotioun (Myosin), Bewegung vun Zellen am Kierper (zum Beispill, amoeboid Bewegung vu Leukozyten), Bewegung vu Cilia a Flagella, souwéi aktive an direkten intrazellularen Transport (Kinesin, Dynein) An. Dyneins a Kinesine transportéieren Moleküle laanscht Mikrotubüle mat der ATP Hydrolyse als Energiequell. Dyneins transferéieren Molekülen an Organellen aus de peripheren Deeler vun der Zell Richtung den Zentrosome, Kinesine - an der entgéintgesate Richtung. Dyneins sinn och verantwortlech fir d'Bewegung vu Cilia a Flagella vun Eukaryoten. Cytoplasmatesch Varianten vu Myosin kënnen am Transport vu Molekülen an Organoiden duerch Mikrofilamenter involvéiert ginn.
Proteinen am Stoffwiessel
Déi meescht Mikroorganismen a Planzen kënnen 20 Standard Aminosäuren synthetiséieren, souwéi zousätzlech (net-Standard) Aminosaieren, wéi Citrulline.Awer wann Aminosaieren an der Ëmwelt sinn, spueren och Mikroorganismen Energie andeems Aminosaieren an d'Zellen transportéieren an hir biosynthetesch Weeër ofschalten.
Aminosaieren, déi net vun Déieren synthetiséiert kënne ginn, ginn essentiell genannt. D'Haaptenzzymen an biosynthetesche Weeër, zum Beispill Aspartat Kinase, déi den éischte Schrëtt an der Bildung vu Lysin, Methionin an Threonin aus Aspartat katalyséieren, si bei Déieren net do.
Déieren kréien haaptsächlech Aminosaieren aus de Proteinen, déi a Liewensmëttel fonnt ginn. Proteine ginn zerstéiert während der Verdauung, déi normalerweis mat der Denaturatioun vum Protein ufänkt andeems en an eng sauer Ëmfeld plazéiert an et hydrolyséiert mat Hëllef vun Enzymen, genannt Proteasen. E puer Aminosäuren, déi als Resultat vun der Verdauung kritt goufen, ginn benotzt fir Kierperproteinen ze synthetiséieren, während de Rescht während Gluconeogenese an d'Glucose ëmgewandelt gëtt oder am Krebs Zyklus benotzt gëtt. D'Benotzung vu Protein als Energiequell ass besonnesch wichteg an de Fester, wann de Kierper seng eege Proteine, besonnesch Muskelen, als Energiequell déngen. Aminosaieren sinn och eng wichteg Quell vu Stickstoff an der Ernärung vum Kierper.
Et gi keng vereenegt Norme fir mënschlech Protein ofgeroden. D'Mikroflora vum groussen Darm synthetiséiert Aminosaieren, déi net an der Preparatioun vu Proteinormen berücksichtegt ginn.
Studiemethoden
D'Struktur a Funktioune vu Proteine gi souwuel op purifizéiert Virbereedunge studéiert in vitro, an an hirem natierlechen Ëmfeld an engem liewegen Organismus, in vivoAn. Studien vu reinen Proteinen ënner kontrolléierte Konditioune sinn nëtzlech fir hir Funktiounen ze bestëmmen: kinetesch Charakteristike vun der katalytescher Aktivitéit vun Enzymen, relativer Affinitéit fir verschidde Substrater, etc. Proteinstudien in vivo a Zellen oder a ganz Organismen zousätzlech Informatiounen iwwer wou se funktionnéieren a wéi hir Aktivitéit geregelt gëtt.
Molekulare a Zellular Biologie

Molekulär a cellulär Biologie Methoden ginn allgemeng benotzt fir d'Synthese an d'Lokaliséierung vu Proteinen an enger Zell ze studéieren. Eng Method fir d'Lokaliséierung ze studéieren ass wäit benotzt, baséiert op der Synthese vun engem chimeresche Protein an enger Zell, besteet aus dem studéierte Protein, verbonne mat engem "Reporter", zum Beispill, gréng fluoreszent Protein (GFP). De Standuert vun sou engem Protein an der Zell ka mat Hëllef vun engem Fluoreszenzmikroskop gesi ginn. Zousätzlech kënnen Proteine visualiséiert ginn mat Antikörper, déi se erkennen, déi am Tour e fluoreszent Label droen. Oft, gläichzäiteg mam studéierte Protein, dacks bekannt Proteine vun esou Organellen wéi den endoplasmatesche Retikulum, Golgi Apparat, Lysosomen, a Vakuole gi visualiséiert, wat et erlaabt eng méi genau Bestëmmung vun der Lokaliséierung vum studéierte Protein ze maachen.
Immunohistochemesch Methoden benotze normalerweis Antikörper, déi an Enzyme konjugéiert sinn, déi d'Bildung vun engem lumineszentem oder faarwege Produkt katalyséieren, wat Iech erlaabt d'Lokaliséierung a Betrag vu Protein an de Proben ze vergläichen. Eng méi selten Technik fir d'Location vun Proteinen ze bestëmmen ass d'Gläichgewiicht Ultrazentrifugatioun vun Zell Fraktiounen am Gradient vun der Sackarose oder Cesiumchlorid.
Schlussendlech ass eng vun de klassesche Methoden immunoelektronesch Mikroskopie, déi grondsätzlech ähnlech wéi Immunfluoreszenzmikroskopie mam Ënnerscheed datt en Elektronmikroskop benotzt gëtt. D'Prouf ass fir Elektronmikroskopie virbereet, an dann mat Antikörper zu engem Protein veraarbecht, dat un elektron-dichtem Material, meeschtens Gold, verbonne sinn.
Mat Hëllef vu Sitegeriicht Mutagenese kënnen d'Fuerscher d'Aminosauer Sequenz vun engem Protein änneren an doduerch seng raimlech Struktur, d'Location an der Zell an d'Reguléierung vun hirer Aktivitéit. Mat dëser Method, mat modifizéierten tRNAs, kënne kënschtlech Aminosäuren och an e Protein agefouert ginn a Proteine mat neie Eegeschafte kënne konstruéiert ginn.
Biochemesch
Fir eng Analyse ze maachen in vitro de Protein muss aus aneren Zellular Komponenten gereinegt ginn. Dëse Prozess fänkt normalerweis mat der Zerstéierung vun Zellen un an kritt de sougenannten Zellxtrakt. Weider, duerch Zentrifugéierung an Ultraszentrifugéierungsmethoden, kann dësen Extrakt agedeelt ginn: eng Fraktioun mat soluble Proteinen, eng Fraktioun mat Membranlipiden a Proteinen, an eng Fraktioun mat Zellorganer an Nukleinsäuren.

Protein Ausfällung duerch Aussaugung gëtt benotzt fir Proteinmëschungen ze trennen, an erlaabt och Protein Konzentratioun. Sedimentatiounsanalyse (Zentrifugatioun) erlaabt Iech Proteinmëschunge mam Wäert vun der Sedimentatiounskonstant vun eenzelne Proteinen ze fraktionéieren, gemooss an Svedbergs (S). Verschidde Arten vu Chromatographie ginn dann benotzt fir dat gewënschte Protein oder Proteine ze isoléieren baséiert op Eegeschafte wéi molekulare Gewiicht, Ladung an Affinitéit. Zousätzlech kënnen Proteine isoléiert ginn no hirer Ladung mat Elektrofokus.
Fir de Prozess vun der Proteinreinung ze vereinfachen, gëtt genetesch Ingenieuren dacks benotzt, wat Iech erlaabt Derivate vu Proteinen ze kreéieren déi praktesch fir d'Rengung sinn ouni hir Struktur oder Aktivitéit ze beaflossen. "Etiketten", déi kleng Aminosauer Sequenze sinn, zum Beispill, eng Kette vu 6 oder méi Histidinreschter, a si sinn un engem Enn vum Protein befestegt. Wann den Extrakt vun den Zellen, déi de "labeléierten" Protein synthetiséieren, duerch eng chromatografesch Kolonn mat Nickel-Ionen weidergeet, bindt Histidin mat Nickel a bleift op der Kolonn, während déi verbleiwen Komponenten vun der Lysat duerch d'Kolonn ongehindert passen (Nickel-Chelat-Chromatografie). Vill aner Etiketten sinn entwéckelt fir Fuerscher ze hëllefen spezifesch Proteinen aus komplexe Mëschungen ze isoléieren, meeschtens mat Affinitéitskromatographie benotzt.
De Grad vun der Proteinreinung kann bestëmmt ginn ob säi Molekulargewicht an den isoelektresche Punkt bekannt sinn - mat verschiddenen Zorte vu Gelelektrophorese benotzt - oder duerch d'Miessung vun der enzymatescher Aktivitéit wann de Protein en Enzym ass. Massespektrometrie erlaabt Iech dat gewielte Protein duerch säi Molekulargewiicht an d'Mass vu senge Fragmenter z'identifizéieren.
Proteomik
D'Totalitéit vun Zellproteine gëtt e Proteome genannt, seng Studie - Proteomik, genannt Analogie mat Genomik. Schlëssel experimentell Proteomik Methoden enthalen:
- 2D Elektrophorese, wat d'Trennung vu multikomponenten Proteinmëschungen erlaabt,
- Massespektrometrie, wat d'Identifikatioun vu Proteine duerch d'Mass vun hire bestännegen Peptide mat héijer Duerchgang erméiglecht,
- protein microarrays, wat Iech erlaabt den Inhalt vun enger grousser Zuel vu Proteinen an der Zell gläichzäiteg ze moossen,
- zwee-Hybrid Heissystem , wat Iech erlaabt systematesch Protein-Protein Interaktiounen ze studéieren.
D'Totalitéit vun all biologesch bedeitend Interaktioune vu Proteinen an enger Zell nennt een Interaktom. Eng systematesch Studie vun der Struktur vu Proteinen, déi all méiglech Aarte vu tertiären Strukturen representéieren, gëtt strukturell Genomik genannt.
Struktur Prognose a Modellering
Prognose vu Raumstruktur mat Hëllef vu Computerprogrammer (a Silico) erlaabt Proteinmodeller ze konstruéieren deenen hir Struktur nach net experimentell bestëmmt gouf. Déi erfollegräichst Zort vu strukturelle Prognose, bekannt als homologesch Modellerung, hänkt vun der existenter "Template" Struktur of, ähnlech an der Aminosauer Sequenz zum simuléierte Protein. D'Methode fir d'raimlech Struktur vu Proteinen ze predizéieren ginn am Entwécklungsfeld vun der genetescher Ingenieurswirkung vu Proteine benotzt, mat der Hëllef vun deenen nei tertiär Strukture vu Proteine scho kritt goufen. Eng méi komplex berechend Aufgab ass d'Prognose vu intermolekuläre Interaktiounen, wéi molekulär Docking an d'Prognose vu Protein-Protein Interaktiounen.
Déi ausklappend an intermolekulär Interaktioune vu Proteine kënne mat Hëllef vu molekulare Mechanik modelléiert ginn. , besonnesch molekulär Dynamik an der Monte Carlo Method, déi ëmmer méi profitéiere vu parallel a verdeelt Informatik (zum Beispill de Folding @ home Projet).D'Valtung vu klenge α-helikale Protein Beräicher, wéi Villin Protein oder ee vun den HIV Proteinen, goufen erfollegräich modeliséiert a SilicoAn. Mat Hëllef vun Hybridmethoden déi Standardmolekular Dynamik mat der Quantemechanik kombinéieren, goufen d'elektronesch Staate vum visuellen Pigment Rhodopsin ënnersicht.